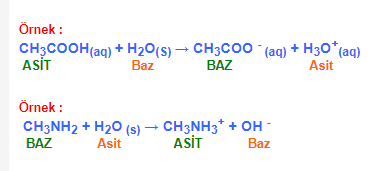Asit Baz Tanımları Nelerdir? Lowry Bronsted Asit Baz Tanımı, Lewis Asit Baz Tanımı ve Arrhenius Asit – Baz Tanımı ne demektir?Asit Baz Tanımları Konu Anlatımı Örnekler
ASİT BAZ TANIMLARI
En çok bilinen asit baz tanımları aşağıdadır
1. Lowry -Bronsted-Asit –Baz Tanımı
2.Lewis Asit – Baz Tanımı
3.Arrhenius Asit – Baz Tanımı
Detaylı olarak inceleyelim
1. Lowry Bronsted Asit Baz Tanımı Konu Anlatımı Örnekler
1923 yılında İngiliz T. M. Lowry ile Danimarkalı J. N. Brønsted birbirinden bağımsız olarak asitleri ve bazları
» Proton veren (H+) madde asit,
» proton alan (H+) madde bazdır.
şeklinde tanımlamışlardır.
»Kimyasal tepkimelerde,
H+ iyonu veren maddeler ASİT ,
H+ iyonu alabilen maddelere BAZ denir.
Bu tür asit ve baz çiftine konjuge (eşlenik) asit baz çifti denir.
NH3 + H2O →NH4+ + OH–
BAZ Asit ASİT Baz
» Tepkimesinde H2O, NH3‘a proton (H+) verdiği için asit,
»NH3ise proton (H+) aldığı için bazdır.
»Brønsted-Lowry tanımına göre H2O-OH– ve NH3-NH4+ gibi çiftler eşlenik (konjuge) asit-baz çiftleridir
Örnek :
CH3COOH(aq) + H2O(S) → CH3COO – (aq) + H3O+(aq)
ASİT Baz BAZ Asit
Örnek :
CH3NH2 + H2O (s) → CH3NH3+ + OH –
BAZ Asit ASİT Baz
Büyük harfli olanlar kendi arasında konjuge asit baz çiftidir
Küçük harfli olanlar kendi arasında konjuge asit baz çiftidir
Her asit, proton verince bir baza; her baz da proton alınca bir aside dönüşür.
OH– iyonu verebilen bileşiklerin proton bağlama yetileri olduğundan NaOH, KOH, Mg(OH)2, Ca(OH)2 ve Fe(OH)3 gibi bileşikler baz karakteri taşır.
NOT:
Örnek 1 de H2O (H+) iyonu verdiği için ASİT
Örnek 2 de H2O (H+) iyonu aldığı için BAZ olarak davranmıştır.
Verilen örneklerde su amfoter olarak davranmıştır .
H2O, Örnek 1 de ASİT gibi , Örnek 2 de ise BAZ gibi davranmıştır. Bazı tepkimelerde asit, bazı tepkimelerde baz olarak davranan bu tür bileşiklere amfoter bileşikler denir.
2.Lewis Asit Baz Tanımı Konu Anlatımı Örnekler
Lewis asit – baz tanımına göre;
Asit, elektron çifti alabilen madde, baz ise elektron çifti verebilen maddedir.Yani;
-Elektron çifti alabilen madde Lewis Asidi,
-Elektron çifti verebilen madde Lewis Bazı olarak tanımlanır.
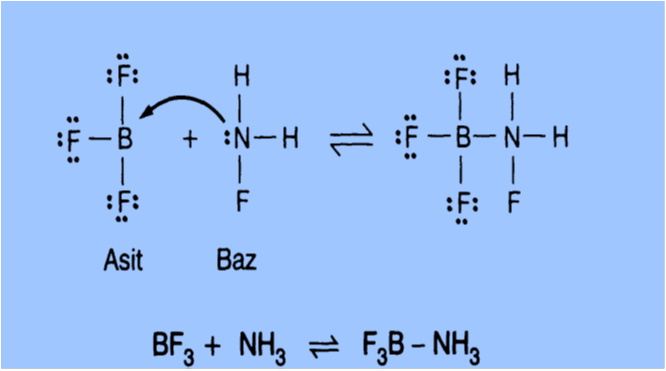
Yapıların elektronik yapısı dikkate alınarak aşağıda incelenmiştir.
Yukarıdaki yapıdan da görüldüğü gibi BF3‘de B atomunun dış enerji düzeyinde 6 elektron vardır. Bu nedenle iki elektron yani bir elektron çifti alabilecek boş orbitali vardır. Dolayısıyla BF3 Lewis asididir. NH3 teki N atomunda ise bağ yapmamış serbest bir çift elektron vardır. NH3 bu elektron çiftini verdiği için Lewis bazıdır.
3.Arrhenius Asit Baz Tanımı Konu Anlatımı Örnekler
Arrhenius asit – baz tanımına göre;
»Sulu çözeltilerine H+ iyonu veren bileşikler asit, OH” iyonu verebilen maddeler ise bazdır.
»H+ iyonunda elektron yoktur. Tamamen pozitif yükten oluştuğu için sulu çözeltilerde H20 molekülü ile birleşerek H30+ iyonunu (hidronyum) oluşturur.
» Asitlerin sulu çözeltilerinde H+ çözücü ortamında serbest olarak bulunamaz. Mutlaka bir su molekülüyle etkileşir ve H3O+ iyonu oluşturur. Bu iyona hidronyum iyonu denir.
» Bu nedenle H+ ve H30+ iyonları birbirlerinin yerine kullanılabilir. HCI, HN03 ve CH3COOH gibi maddeler Arrhenius asididir.
Asitler H+ iyonu verir.
HCI(aq) → H+(aq) + Cl– (aq
H2SO4(aq) →2H+(aq) + SO4-2 (aq)
HNO3(aq) →H+(aq) + NO3-1 (aq)
H3PO4(aq) → 3H+(aq) + PO4-3 (aq)
CH3COOH →CH3COO– + H+(aq)
Bazlar OH– iyonu verir.
NaOH (aq)
→ Na+(aq) + OH–
(aq)
Mg(OH)2(aq) →Mg+2(aq) + 2OH–
(aq)
Al(OH)3(aq → Al +3(aq) + 3OH–
(aq)
Ba(OH)2(aq → Ba+2(aq) + 2OH–
(aq)
NH3 + H2O → NH4+ + 1OH–
NOT:Aşağıdaki pdf dosyalarında bulunan konu anlatımı ve soruların videolu anlatımını aşağıda verilen youtube linklerinde bulabilirsiniz.
10.SINIF ASİTLER BAZLAR TUZLAR PDF VE VİDEO ÇÖZÜMLERİ
PDF LİNKİ;
 ASİTLER BAZLAR TUZLAR PDF İndirmek İçin TIKLA (Video Çözümlü)
ASİTLER BAZLAR TUZLAR PDF İndirmek İçin TIKLA (Video Çözümlü)
NOT:Yukarıdaki pdf dosyalarında bulunan konu anlatımı ve soruların videolu anlatımını aşağıda verilen youtube linklerinde bulabilirsiniz.
 ASİTLER BAZLAR TUZLAR –1 Asitler ve Bazların Genel Özellikleri
ASİTLER BAZLAR TUZLAR –1 Asitler ve Bazların Genel Özellikleri
ASİTLER BAZLAR TUZLAR -2 Nötralleşme Tepkimeleri Tuzlar Ph Kavramı
ASİTLER BAZLAR TUZLAR -3 OKSİTLER Türleri Asitliği Bazlığı
ASİTLER BAZLAR ve TUZLAR 4 Asitler ve Bazların Metallerle Tepkimeleri
ASİT 5 ASİTLER BAZLAR TUZLAR –5 Asit Baz Kullanımı Asit Yağmurları
 6-Asitler Bazlar ve Tuzlar SORU ÇÖZÜMLERİ
6-Asitler Bazlar ve Tuzlar SORU ÇÖZÜMLERİ
10.SINIF KİMYA KAZANIM TESTLERİÇÖZÜMLERİ İÇİN TIKLA
|