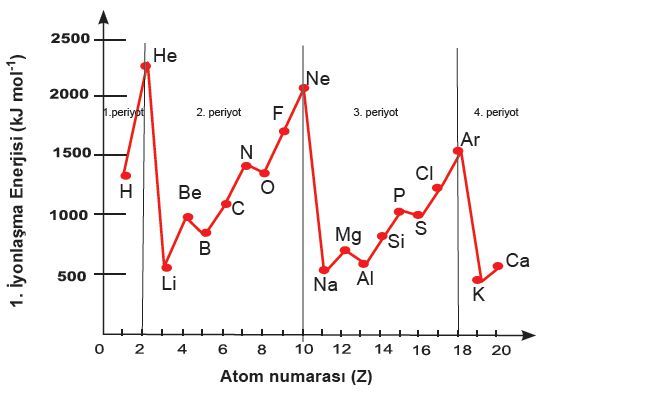
İyonlaşma Enerjisi ,Gaz halindeki nötr bir atomdan bir elektron koparmak için gerekli enerjidir
» Gaz halindeki nötr bir atomun son yörüngesinden bir elektron koparmak için gerekli enerjiye İyonlaşma Enerjisi denir
» Gaz halindeki nötr atomdan bir elektron koparmak için gereken enerji İyonlaşma enerjisidir.
» İyonlaşma enerjisi endotermik bir olaydır.
İyonlaşma enerjisi nasıl Hesaplanır
Bir atomun iyonlaşma enerjisi gaz boşaltım tüplerine doldurulmuş gaz halindeki elementin, iyonlaştırılmasıyla hesaplanır.
» İlk elektronu koparmak daha kolaydır. Sonraki elektronları koparmak daha zordur.
Al(g) → Al+(g) + e– E1 = 580 kJ/mol E1 = I.İE
Al+(g) → Al2+(g) + e– E2 = 1815 kJ/mol
Al2+(g) → Al3+(g) + e– E3 = 2740 kJ/mol
Al3+(g) → Al4+(g) + e– E4 = 11,600kJ/mol
E1 < E2 < E3 < E4
E1 < E2 < E3 < E4< ………… En
İlk elektronu koparmak daha kolaydır.Sonraki elektronları koparmak daha zordur.
İE1 < İE2 < İE3 < İE4< ………… İEn
Bir elektron verip iyonlaşan bir atomda e sayıları azalmıştır.Kalan elektronlar çekirdek tarafından daha çok çekilirler.Yani çekirdek tarafından 1 elektrona uygulanan çekim kuvveti artmıştır. Dolayısıyla ikinci elektronu koparmak için gereken enerji bir öncekinden daha büyük olur. Onun için 2.İE, 1.İE den daha fazladır.
» Bir atomun soy gaz durumundan elektron koparmak çok güçtür.
Bir atomun soy gaz durumundan elektron koparmak çok güçtür1., 2, 3. İyonlaşma enerjilerindeki artışlar normaldir. Ancak 4. elektron kopartılırken ani bir sıçrama görülür.
Öyleyse kolay koparılan elektronlar değerlik elektronlardır.Demekk ki 3 tane değerlik e var,Yani soygazdan 3 fazla e var.Bu da 3 A grubuna denk gelir
3 e verdiğinde enerji çok artmış ve soygaz düzenine geçmiştir.
Değerlik elektron sayısı: 3 Grubu :3A
Kararlı bileşiklerindeki değerliği:+3
1e 2e 3e verdiğnde
| (kJ/mol) | İE1 | İE2 | İE3 | İE4 |
| Al | 580 | 1815 | 2740 | 11,600 |
2,5katı 1,5katı 5 katı
 9.SINIF KİMYA KAZANIM TESTLERİ ÇÖZÜMLERİ İÇİN TIKLA
9.SINIF KİMYA KAZANIM TESTLERİ ÇÖZÜMLERİ İÇİN TIKLA
İyonlaşma Enerjisi Tablosu Soruları Grup Bulma
Örnek:X, Y, Z, T maddelerinin grup numaralarını bulalım
| İE1 | İE2 | İE3 | İE4 | Grubu | |
| X | 125 | 255 | 689 | ↑6582 | 3 A |
| Y | 568 | 1050 | 16500 | 2A | |
| Z | 426 | 5360 | 12530 | 1A | |
| T | 145 | 365 | ↑3630 | 4560 | 2A |
| K | 125 | 259 | 554 | 1108 | 1-A,2-A,3-A Değil |
| L | 1312 | —— | ——— | ——— | yalnız1 e verebildiği için 1H |
| M | 2373 | 5251 | ——— | ——— | Yalnız2e verebildiği için 2He |
1e 2e 3e
Yukardaki tabloda enerjinin artması kat olarak incelenir.Enerjinin en çok katı kadar arttığı yerde soygaz düzenine geçilmiştir.Mesela X maddesinde
1e verdiğinde 2 katı 2e verdiğinde 2 katı 3e verdiğinde 9 katına çıkmıştır. Yani 3 e verdiğinde soygaz düzenine geçmiştir ve enerjisi çok fazla artmıştır
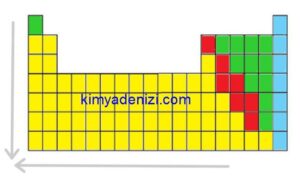
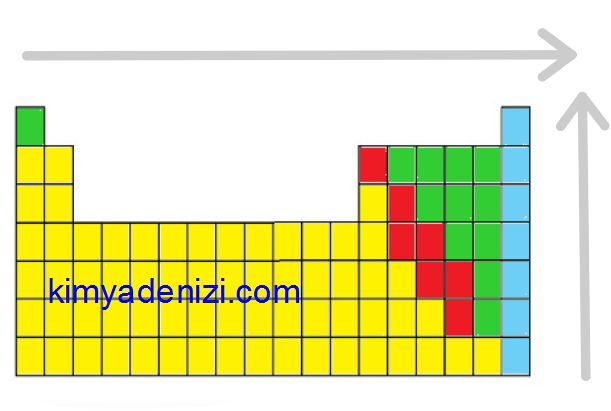
PERYODİK CETVELDE İYONLAŞMA ENERJİSİ DEĞİŞİMİ
Genel olarak peryodik cetvelde;
Soldan Sağa İyonlaşma Enerjisi ARTAR
(2A-3A ve 5A-6A istisna)
Aşağıdan Yukarıya İyonlaşma Enerjisi ARTAR
İyonlaşma Enerjisi ARTAR
Peryodik Cetvelde;
Sağdan Sola İyonlaşma Enerjisi AZALIR
Yukarıdan Aşağıya İyonlaşma Enerjisi AZALIR
İyonlaşma Enerjisi azalır
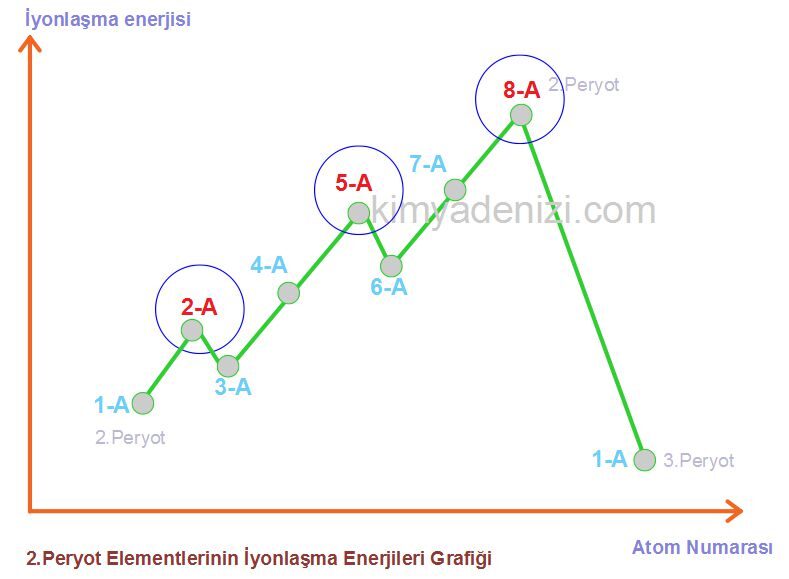
***** 2-A Ve 5-A Gruplarının İyonlaşma Enerjileri İstisnası
Aynı periyotta, değerlik elektron sayısı arttıkça iyonlaşma enerjisi genellikle artar. Ama 2A ve 5A grupları küresel simetrik özellik gösterir ve kuralı bozar
Bu düzensizliğin sebebi, küresel simetridir.
İyonlaşma Enerjisi Grafiği Grafik Soruları istisnalar
»» 2A ve 5A grupları küresel simetrik özellik gösterir ve kuralı bozar.
1A < 3A < 2A < 4A < 6A < 5A < 7A < 8A
İyonlaşma Enerjisi Karşılaştırma Çözümlü Örnek Sorular
iyonlaşma enerjisi ile ilgili sorular 9.sınıf iyonlaşma enerjisi örnek sorular
iyonlaşma enerjisi örnekleri iyonlaşma enerjisi sıralama soruları,
AYNI GRUPTA İSELER
SORU:
2He, 10Ne , 18Ar iyonlaşma enerjilerini karşılaştırınız.
|
|
|
| ||
| 1.K | 2.K | 3.K |
|
|
2He | 2 |
|
| 1.Peryot | 8-A |
10Ne | 2 | 8 |
| 2.Peryot | 8-A |
18Ar | 2 | 8 | 8 | 3.Peryot | 8-A |
kimyadenizi.com | |||||
2He, Des 2 ama 8A grubundadır..İSTİSNA….
Üçü de 8-A grubunda
Alt alta gelirler.
Grupta aşağıdan yukarıya doğru iyonlaşma enerjisi artar
Yani aynı grupta katman sayısı az olanın iyonlaşma enerjisi dahafazladır
2He > 10Ne > 18Ar
8A 8A 8A
2He | ↑ |
10Ne | |
18Ar |
Örnek:
4Be, 12Mg ,20Ca iyonlaşma enerjilerini karşılaştırınız.
|
|
|
|
| ||
| 1.K | 2.K | 3.K | 4.K | Katman sayısı (Peryot No) |
|
4Be | 2 | 2 |
|
| 2.Peryot | 2-A |
12Mg | 2 | 8 | 2 |
| 3.Peryot | 2-A |
20Ca | 2 | 8 | 8 | 2 | 4.Peryot | 2-A |
Üçünün de sonu 2 ile biter ,Aynı grup demektir,2-A grubu
Alt alta gelirler.
Grupta aşağıdan yukarıya doğru iyonlaşma enerjisi artar
Yani aynı grupta katman sayısı az olanın peryot no su az olanın iyonlaşma enerjisi daha fazladır
4Be | ↑ |
12Mg | |
20Ca |
4Be > 12Mg > 20Ca
2K 3K 4 Katmanlı
AYNI PERYOTTA
Örnek:
12Mg, 16S ,18Ar iyonlaşma enerjilerini karşılaştırınız.
| 1.K | 2.K | 3.K |
|
|
12Mg | 2 | 8 | 2 | 3.Peryot | 2-A . |
16S | 2 | 8 | 6 | 3.Peryot | 6-A |
18Ar | 2. | 8 | 8 | 3.Peryot | 8-A |
Üçü de 3 katmanlı yani 3. Peryotta
Aynı peryotta soldan sağa doğru iyonlaşma enerjisi artar
| 12Mg | …….. | 16S | 18Ar | |
| → | ||||
Sola doğru yarıçap artar
18Ar > 16S >12Mg
AYNI PERYOTTA
Örnek:
12Mg, 14Si ,18Ar iyonlaşma enerjilerini karşılaştırınız.
|
|
|
| ||
| 1.K | 2.K | 3.K | Katman sayısı (Peryot No) |
|
12Mg | 2 | 8 | 2 | 2.Peryot | 2-A |
14Si | 2 | 8 | 4 | 3.Peryot | 4-A |
18Ar | 2 | 8 | 8 | 3.Peryot | 8-A |
Üçü de 3 katmanlı yani 3. Peryotta
Aynı peryotta soldan sağa doğru iyonlaşma enerjisi artar
| 12Mg | 14Si | 18Ar | ||
| → | ||||
<img.png” alt=”” />
Sağa doğru iyonlaşma enerjisi artar
12Mg > 14Si > 18Ar
2-A 4-A 8-A
İyonlaşma Enerjisi İstisnaları Örnekler
(2A-3A ve 5A-6A İstisnaları Örnekler)
Örnek:
12Mg, 13Al ,17Cl İyonlaşma enerjilerini karşılaştırınız.
|
|
|
| ||
| 1.K | 2.K | 3.K | Katman sayısı (Peryot No) |
|
12Mg | 2 | 8 | 2 | 3.Peryot | 2-A |
13Al | 2 | 8 | 3 | 3.Peryot | 3-A |
17Cl | 2 | 8 | 7 | 3.Peryot | 7-A |
Grup no su fazla olanın İE si fazladır ama
2A ve 3A istisnası var
2A >3A
17Cl > 12Mg > 13Al
7A 2A 3A
Örnek:
7N, 8O ,10Ne İyonlaşma enerjilerini karşılaştırınız.
|
|
|
| ||
| 1.K | 2.K | 3.K | Katman sayısı (Peryot No) |
|
7N | 2 | 5 | 2.Peryot | 5-A | |
8O | 2 | 6 | 2.Peryot | 6-A | |
10Ne | 2 | 8 | 2.Peryot | 8-A | |
Grup no su fazla olanın İE si fazladır ama
5A ve 6A istisnası var
5A >6A
10Ne > 7N > 8O
8A 5A 6A
NOT:
ΦYukarda verilen maddelerle yalnızca AYNI GRUPTA veya AYNI PERYOTTA iseler karşılaştırma yapabiliriz.
Ama farklı peryotlarda iseler veya farklı gruplarda iseler karşılaştırma yapamayız
Aşağıdaki kurallarla peryodik cetvelin herhangi bir yerindeki atom veya iyonlarda genel olarak karşılaştırma yapabiliriz
İYONLAŞMA ENERJİLERİ KARŞILAŞTIRMA
(Farklı Grup-Farklı Peryot-Atom İyon)
»» Değerlik e sayısı büyük olanın ,yani grup numarası büyük olanın İE si daha büyüktür.
( 2A ve 5A grupları istisna daha doğrusu değ.el.say 2 ve 5 olanlar istisna,en son maddede açıklanmıştır.
11Na11: 2.8 .1 Des:1 1-A
7N7: 2.5 Des:5 5-A
16S18-2: 2.8.8 Des:8 8-A
İE 16S18-2>7N7 > 11Na11
Değerlik e sayısı en büyük olan 16S18-2 dir. İE si en büyük olandır
»» Değerlik e sayısı aynı ise katman sayısı az olanın İE si daha büyüktür.Yani katman sayısı az olandan e koparmak daha zordur.
10Ne10 : 2.8 Des:8 2 yörüngeli
18Ar18 : 2.8.8 Des:8 3 yörüngeli
İE 10Ne10 >18 Ar18
»» Değerlik e sayısı ve elektron sayısı aynı ise protonu fazla olanın İE si daha büyüktür.
Ya da p/e oranına bakılır. p/e oranı çok olandan e koparmak daha zordur.Çekim kuvveti daha fazladır
20 Ca18+2 :2.8.8 Des:8 El.S:18
19K18+1 :2.8.8 Des:8 El.S:18
Des ve Elektron sayıları aynıdır.
20Ca18+2>19K18+1
p/e 20/18 19/18
çekimi fazla olan 20Ca18+2 dir
Örnek:
12Mg, 16S ,18Ar İyonlaşma enerjilerini karşılaştırınız.
| 1.K | 2.K | 3.K | |||
| 12Mg | 2 | 8 | 2 | 3.Peryot | 2-A |
| 16S | 2 | 8 | 6 | 3.Peryot | 6-A |
| 18Ar | 2. | 8 | 8 | 3.Peryot | 8-A |
| kimyadenizi.com | |||||
Üçü de 3 katmanlı yani 3. Peryotta aynı peryotta soldan sağa İ.E artar
| 12Mg | …….. | 16S | 18Ar |
İ.E sağa doğru artar
18Ar > 16S >12Mg
Örnek:
2He, 10Ne , 18Ar İyonlaşma enerjilerini karşılaştırınız.
| 1.K | 2.K | 3.K | |||
| 2He | 2 | 1.Peryot | 8-A | ||
| 10Ne | 2 | 8 | 2.Peryot | 8-A | |
| 18Ar | 2 | 8 | 8 | 3.Peryot | 8-A |
| kimyadenizi.com | |||||
2He, Des 2 ama 8A grubundadır..İSTİSNA….
Üçü de 8-A grubunda
Grup no aynı ise Katman sayısına bakılır;
Katman sayısı küçük olanın İ.E si daha büyüktür
2He > 10Ne>18Ar >
8A 8A 8A
Ya da daha kısa bir şekilde;
Aynı grupta Yukarıya doğru İE Azalır diye de düşünülebilir
Örnek:
4Be, 12Mg ,20Ca İyonlaşma enerjilerini karşılaştırınız
| 1.K | 2.K | 3.K | 4.K | Katman sayısı (Peryot No) | ||
| 4Be | 2 | 2 | 2.Peryot | 2-A | ||
| 12Mg | 2 | 8 | 2 | 3.Peryot | 2-A | |
| 20Ca | 2 | 8 | 8 | 2 | 4.Peryot | 2-A |
Üçünün de sonu 2 ile biter ,Aynı grup demektir,2-A grubu
Alt alta gelirler.Grupta aşağıdan yukarı İ.E artar
4Be > 12Mg >20Ca
2K 3K 4 Katmanlı
Örnek:
4Be, 13Al ,18Ar İyonlaşma enerjilerini karşılaştırınız.
| 1.K | 2.K | 3.K | Katman sayısı (Peryot No) | ||
| 4Be | 2 | 2 | 2.Peryot | 2-A | |
| 13Al | 2 | 8 | 3 | 3.Peryot | 3-A |
| 18Ar | 2 | 8 | 8 | 3.Peryot | 8-A |
Grup no su fazla olanın İE si fazladır ama
2A ve 3A istisnası var
2A >3A
18Ar > 4Be > 13Al
8A 2A 3A
Örnek
4Be, 16S, 15P , 19K iyonlaşma enerjilerini karşılaştırınız.
| 1.K | 2.K | 3.K | 4.K | Katman sayısı (Peryot No) | ||
| 4Be | 2 | 2 | 2.Peryot | 2-A | ||
| 16S | 2 | 8 | 6 | 3.Peryot | 6-A | |
| 15P | 2 | 8 | 5 | 3.Peryot | 5-A | |
| 19K | 2 | 8 | 8 | 1 | 4.Peryot | 1-A |
Grup Numarası büyük olanın İ.E si daha büyüktür ,
Ama 5A>6A İstisnası Bulunuyor
15P >16S >4Be >19K
5A 6A 2A 1A
Periyodik Sistem ve Özellikleri -2 / Periyodik Özellikler
Örnek:
7N, 8O , 20Ca iyonlaşma enerjilerini karşılaştırınız.
| 1.K | 2.K | 3.K | 4.K | Katman sayısı (Peryot No) | ||
| 7N | 2 | 5 | 2.Peryot | 5-A | ||
| 8O | 2 | 6 | 2.Peryot | 6-A | ||
| 20Ca | 2 | 8 | 8 | 2 | 4.Peryot | 2-A |
Grup Numarası büyük olanın İ.E si daha büyüktür ,
Ama 5A>6A İstisnası Bulunuyor
7N > 8O >20C
5A 6A 2A
2. İyonlaşma Enerjisi ve 3.İyonlaşma Enerjileri Karşılaştırma Konu Anlatımı Çözümlü Örnek Sorular
İkinci İyonlaşma enerjilerine bakılırken 1 e verilerek bakılır .1 e daha verilirse de 3. İyonlaşma enerjilerine bakılır.
1. İyonlaşma enerjilerine bakalım.
19X19:2.8.8.1
12Y12:2.8.2
12Y12 >19X19 1.İy.En
2. İyonlaşma enerjilerine bakmak için 1 er e verilir e dizilişi yapılır
19X18+1:2.8.8
12Y11+1:2.8.1
19X18+1> 12Y11+1 2.İy.En.
3. İyonlaşma enerjilerine bakmak için 1 er e daha verilir e dizilişi yapılır
19X17+2:2.8.7
12Y10+2:2.8
12Y10+2 > 19X17+2 3.İy.En.
2 iyonlaşma enerjisi karşılaştırma, 2. iyonlaşma enerjisi, 2. iyonlaşma enerjisi soruları, elektronegatiflik ve iyonlaşma enerjisi periyodik sistemde nasıl değişir, ikinci iyonlaşma enerjisi sıralaması, iyonlarda iyonlaşma enerjisi, iyonlaşma denklemi, iyonlaşma enerjisi, iyonlaşma enerjisi 9. sınıf, iyonlaşma enerjisi bulma, iyonlaşma enerjisi cozumlu soru, iyonlaşma enerjisi grafiği, iyonlaşma enerjisi grafik, iyonlaşma enerjisi grup bulma, iyonlaşma enerjisi hesaplama, iyonlaşma enerjisi hocalara geldik, iyonlaşma enerjisi ile atom çapı arasındaki ilişki, iyonlaşma enerjisi ile ilgili sorular, iyonlaşma enerjisi ile ilgili sorular 9.sınıf, iyonlaşma enerjisi istisnaları, iyonlaşma enerjisi karşılaştırma, iyonlaşma enerjisi kıyaslama, iyonlaşma enerjisi kıyaslaması sıralaması karşılaştırma, iyonlaşma enerjisi konu anlatımı, iyonlaşma enerjisi nasıl hesaplanır, iyonlaşma enerjisi ne demek, iyonlaşma enerjisi örnek, iyonlaşma enerjisi örnek sorular, iyonlaşma enerjisi örnekleri, iyonlaşma enerjisi periyodik cetvelde, iyonlaşma enerjisi periyodik sistemde nasıl değişir, iyonlaşma enerjisi sıralama, iyonlaşma enerjisi sıralama soruları, iyonlaşma enerjisi sıralaması, iyonlaşma enerjisi soldan sağa, iyonlaşma enerjisi soru çözümü, iyonlaşma enerjisi soruları, iyonlaşma enerjisi soruları 9.sınıf, iyonlaşma enerjisi tablo, iyonlaşma enerjisi tablo soruları, iyonlaşma enerjisi tablo sorusu, iyonlaşma enerjisi tablosu, periyodik cetvelde iyonlaşma enerjisi aşağıdan yukarıya nasıl değişir, periyodik cetvelde iyonlaşma enerjisi değişimi, periyodik cetvelde iyonlaşma enerjisi sağdan sola nasıl değişir, periyodik cetvelde iyonlaşma enerjisi soldan sağa nasıl değişir, periyodik cetvelde iyonlaşma enerjisi yukarıdan aşağıya nasıl değişir, soygazlarda iyonlaşma enerjisi
.
.