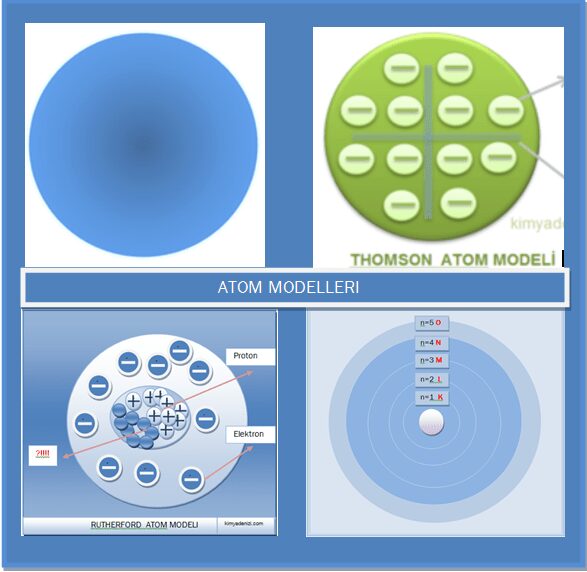
London Kuvvetleri (İndüklenmiş Dipol- İndüklenmiş Dipol Etkileşimleri) Konu Anlatımı Çözümlü Örnek Sorular
»» Apolar moleküller arasındaki etkileşimlerdir
»» İndüklenmiş dipol- indüklenmiş dipol kuvvetleri, ilk kez Fritz London tarafından açıklandığı için bu kuvvetler London Kuvvetleri olarak da adlandırılır.
»» Polar olmayan moleküller arasında çekim kuvvetleri olmasaydı soy gazlar, hidrojen, oksijen , karbon dioksit veya metan gibi apolar maddelerin sıvı hâle geçmesi mümkün olmazdı.
Soygaz atomları arasındaki zayıf etkileşimler, taneciklerinin birbiri ile çarpışması sonucunda oluşan indüklenmiş dipollerden kaynaklanır.
»» London kuvvetleri, elektronların kinetik ve potansiyel enerjiye sahip olmalarından kaynaklanır.
»» Apolar moleküllerde yönü sürekli olarak değişen anlık dipoller oluşur. Bu dipollerin zaman içindeki yükleri ortalaması sıfırdır;kısmi olarak yük oluşsa da dipol momentleri sıfır kabul edilir.
Anlık, geçici olduğu varsayılır. Apolar moleküller İndüklenmiş Dipol olarak adlandırılır.
»» Apolar moleküllerde sürekli negatif veya sürekli pozitif olan belirli bir kısmı yoktur.Bu durumda atom veya molekülün bir tarafı anlık negatif yüklü diğer tarafı anlık pozitif yüklü olur. Bu şekilde oluşan geçici bir dipolün pozitif ucu başka bir moleküle yaklaştığında o molekülün elektronlarını çekebilir.
Geçici dipol bir başka moleküle negatif ucu ile yaklaştığında ise o molekülün elektronlarını itebilir. Bu şekilde indükleme sonucunda diğer molekülde de geçici olarak dipol oluşur.
Birbirine yaklaşan apolar moleküller arasında indüklenmiş dipol-indüklenmiş dipol kuvvetleriyle bir arada tutulur.
İndüklenmiş dipol olan bir molekül ile çevresindeki indüklenmiş dipol arasında bir çekme kuvveti oluşur. İndüklenmiş dipol ile başka indüklenmiş dipol arasında yalnızca çekme kuvveti bulunur
Elektronlar sürekli olarak hareket hâlindedir bundan dolayı herhangi bir anda moleküldeki elektron dağılımı düzgün olmayabilir ve molekülde anlık dipoller oluşur.
»» London kuvvetlerindeki güçlü olmasına rağmen moleküller arası etkileşimlerin en zayıfıdır. .
»» Bütün zayıf etkileşimlerde zayıf da olsa London kuvvetleri oluşur
»» Polar moleküllerde de elektron bulunduğundan London kuvvetleri oluşur ancak daha güçlü dipol-dipol kuvvetlerinin yanında London kuvvetleri genellikle ihmal edilebilecek kadar küçüktür.
»» Diğer moleküller arasında Van Der Waals bağlarının yanı sıra London kuvvetleri de bulunur. Ancak bunlar çoğu zaman ihmal edilebilecek kadar küçüktür
»» Apolar moleküller arasında yalnızca London kuvvetleri bulunur.
»» Ama diğer zayıf etkileşimlerde London kuvvetlerinin yanında başka etkileşimler de bulunur
 9.SINIF KİMYA KAZANIM TESTLERİ ÇÖZÜMLERİ İÇİN TIKLA
9.SINIF KİMYA KAZANIM TESTLERİ ÇÖZÜMLERİ İÇİN TIKLA
|
Örnek: CO2 molekülleri arasındaki etkileşim
co2 indüklenmiş dipol mü london kuvveti mi dipol mü polar mı apolar mı geçici dipol mü kalıcı dipol mü co2 dipol dipol mü
Apolar Apolar
CO2 – CO2
London Kuvvetleri
(İndüklenmiş Dipol –İndüklenmiş Dipoll Etkileşimi)
Örnek: Cl2 molekülleri arasındaki etkileşim
cl2 indüklenmiş dipol mü london kuvveti mi dipol mü polar mı apolar mı geçici dipol mü kalıcı dipol mü cl2 dipol dipol mü
Apolar Apolar
Cl2 – Cl2
London Kuvvetleri
(İndüklenmiş Dipol –İndüklenmiş Dipoll Etkileşimi)
Örnek: He soygaz atomları arasındaki arasındaki etkileşim
Soygaz Soygaz
He – He
London Kuvvetleri
(İndüklenmiş Dipol –İndüklenmiş Dipoll Etkileşimi)
********Etkileşimlere bakılırken Molekülün Polarlığına bakılır
London Kuvvetleri Nelere Bağlıdır?
London Kuvvetleri elektron hareketliliğine bağlı olduğu için elektron sayısı arttıkça soygazlar ve apolar moleküller arasındaki etkileşimler artar.
Soy gaz moleküllerinin elektron sayısı arttıkça kaynama noktaları da artar.
| SOY GAZLAR | Elektron Sayısı | Kaynama Noktası °C) |
| He | 2 | -269 |
| Ne | 10 | -246 |
| Ar | 18 | -186 |
| Kr | 36</str ong> | -152 |
| Xe | 54 | -107 |
| Rn | 86 | -62 |
| kimyadenizi.com | ||
Halojenlerin oda koşullarında bazılarının kat,bazılarının sıvı bazılarının gaz olmalarının sebebi London Kuvvetleridir;
Elektron sayısı arttıkça London kuvvetlerinin etkisi artar
Bu nedenle oda koşullarında;
F2 ve Cl2 gaz hâlde,
Br2 sıvı hâlde
I2 ise katı hâlde bulunur.
7A Grubu | Elektron Sayısı | Kaynama Noktası (°C) | Fiziksel Hali Oda Koşullarında |
| F2 | 18 | -188 | Gaz |
| Cl2 | 34 | -34 | Gaz |
| Br2 | 70 | 59 | Sıvı |
| I2 | 106 | 184 | Katı |
| kimyadenizi.com | |||
5A grubunun hidrürlerinde de moleküldeki elektron sayısı arttıkça London kuvvetlerinin artmasıyla kaynama noktası yükselmiştir.
| 5A Grubu Hidrürleri | Elektron Sayısı | Kaynama Noktası (°C) |
| CH4 | 10 | -162 |
| SiH4 | 18 | -112 |
| GeH4 | 36 | -90 |
| SnH4 | 54 | -52 |
| kimyadenizi.com | ||
.
LONDON KUVVETLERİ ÖRNEKLER SORULAR
SORU: Br2 molekülleri arasındaki etkileşimin türü nedir?
br2 indüklenmiş dipol mü london kuvveti mi dipol mü polar mı apolar mı geçici dipol mü kalıcı dipol mü br2 dipol dipol mü
| Apolar | Apolar |
| Br2 | Br2 |
İndüklenmiş Dipol- İndüklenmiş Dipol Etkileşimi London Kuvvetleri | |
| kimyadenizi.com | |
MOLEKÜLÜN POLARLIĞI POLARLIĞI VİDEOSU İçin Tıkla Kimya Denizi |
Örnek: BH3 molekülleri arasındaki etkileşim
bh3 indüklenmiş dipol mü london kuvveti mi dipol mü polar mı apolar mı geçici dipol mü kalıcı dipol mü bh3 dipol dipol mü
| Apolar | Apolar |
| BH3 | BH3 |
İndüklenmiş Dipol- İndüklenmiş Dipol Etkileşimi London Kuvvetleri | |
| kimyadenizi.com | |
.
Örnek: CCl4 molekülleri arasındaki etkileşim
ccl4 indüklenmiş dipol mü london kuvveti mi dipol mü polar mı apolar mı geçici dipol mü kalıcı dipol mü ccl4 dipol dipol mü
| Apolar | Apolar |
| CCl4 | CCl4 |
İndüklenmiş Dipol İndüklenmiş Dipol Etkileşimi London Kuvvetleri | |
| Birbiri içinde ÇÖZÜNÜR | |
| kimyadenizi.com | |
Örnek: CH4 molekülleri arasındaki etkileşim
ch4 indüklenmiş dipol mü london kuvveti mi dipol mü polar mı apolar mı geçici dipol mü kalıcı dipol mü ch4 dipol dipol mü
| Apolar | Apolar |
| CH4 | CH4 |
İndüklenmiş Dipol İndüklenmiş Dipol Etkileşimi London Kuvvetleri | |
| Birbiri içinde ÇÖZÜNÜR | |
| kimyadenizi.com | |
Örnek: C2H6 molekülleri arasındaki etkileşim
c2h6 indüklenmiş dipol mü london kuvveti mi dipol mü polar mı apolar mı geçici dipol mü kalıcı dipol mü c2h6 dipol dipol mü
| Apolar | Apolar |
| C2H6 | C2H6 |
İndüklenmiş Dipol İndüklenmiş Dipol Etkileşimi London Kuvvetleri | |
| Birbiri içinde ÇÖZÜNÜR | |
| kimyadenizi.com | |
Örnek: CO2 ile BH3 molekülleri arasındaki etkileşim
| Apolar | Apolar |
| CO2 | BH3 |
İndüklenmiş Dipol İndüklenmiş Dipol Etkileşimi London Kuvvetleri | |
| Birbiri içinde ÇÖZÜNÜR | |
| kimyadenizi.com | |
Örnek: CCl4 ile BH3molekülleri arasındaki etkileşim
| Apolar | Apolar |
| CCl4 | BH3 |
İndüklenmiş Dipol İndüklenmiş Dipol Etkileşimi London Kuvvetleri | |
| Birbiri içinde ÇÖZÜNÜR | |
| kimyadenizi.com | |
Örnek: O2 molekülleri arasındaki etkileşim
o2 indüklenmiş dipol mü london kuvveti mi dipol mü polar mı apolar mı geçici dipol mü kalıcı dipol mü o2 dipol dipol mü
| Apolar | Apolar |
| O2 | O2 |
İndüklenmiş Dipol- İndüklenmiş Dipol Etkileşimi London Kuvvetleri | |
| kimyadenizi.com | |
.
Örnek: F2 molekülleri arasındaki etkileşim
f2 indüklenmiş dipol mü london kuvveti mi dipol mü polar mı apolar mı geçici dipol mü kalıcı dipol mü F2 dipol dipol mü
| Apolar | Apolar |
| F2 | F2 |
İndüklenmiş Dipol- İndüklenmiş Dipol Etkileşimi London Kuvvetleri | |
| kimyadenizi.com | |
.
Örnek: H2 molekülleri arasındaki etkileşim
h2 indüklenmiş dipol mü london kuvveti mi dipol mü polar mı apolar mı geçici dipol mü kalıcı dipol mü h2 dipol dipol mü
| Apolar | Apolar |
| H2 | H2 |
İndük lenmiş Dipol- İndüklenmiş Dipol Etkileşimi London Kuvvetleri | |
| kimyadenizi.com | |
.
Örnek: He soygaz atomları arasındaki arasındaki etkileşim
he indüklenmiş dipol mü london kuvveti mi dipol mü polar mı geçici dipol mü kalıcı dipol mü He dipol dipol mü
| Soygaz | Soygaz |
| He | He |
İndüklenmiş Dipol İndüklenmiş Dipol Etkileşimi London Kuvvetleri | |
| Birbiri içinde ÇÖZÜNÜR | |
| kimyadenizi.com | |
.
Örnek: Ar soygaz atomları arasındaki arasındaki etkileşim
ar indüklenmiş dipol mü london kuvveti mi dipol mü polar mı geçici dipol mü kalıcı dipol mü Ar dipol dipol mü
| Soygaz | Soygaz |
| Ar | Ar |
İndüklenmiş Dipol İndüklenmiş Dipol Etkileşimi London Kuvvetleri | |
| Birbiri içinde ÇÖZÜNÜR | |
| kimyadenizi.com | |
.
Örnek: He ile Ar soygaz atomları arasındaki arasındaki etkileşim
| Soygaz | Soygaz |
| Ne | Ar |
İndüklenmiş Dipol İndüklenmiş Dipol Etkileşimi London Kuvvetleri | |
| Birbiri içinde ÇÖZÜNÜR | |
| kimyadenizi.com | |