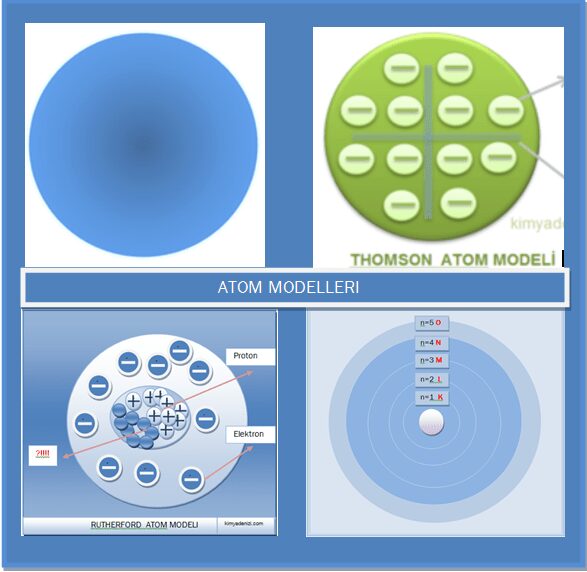
RUTHERFORD ATOM MODELİ Özellikleri Doğruları Eksiklikleri Varsayımları Yanlışları
RUTHERFORD ATOM MODELİ ilk çekirdekli atom modelidir. Thomson Atom modeli ni inceleyerek bazı deneyler yapmıştır.
Thomson atomları ;’’ + yüklü tanecikler arasında yüzen elektron”lardan oluşan içi dolu küre olarak düşünüyordu
– 1911 yılında Ernest Rutherford , arkadaşaları Hans Geiger ve Ernest Marsden ile beraber bazı deneyler yaptılar.
– Deneylerinde Radyoaktif maddelerden yayımlanan alfa aneciklerinin Thomson Atom Modeline uyup uymadığını gözlemlediler
– Alfa tanecikleri 2 elektronunu da kaybetmiş, +2 yüklenmiş Helyum (He) atomlarıdır
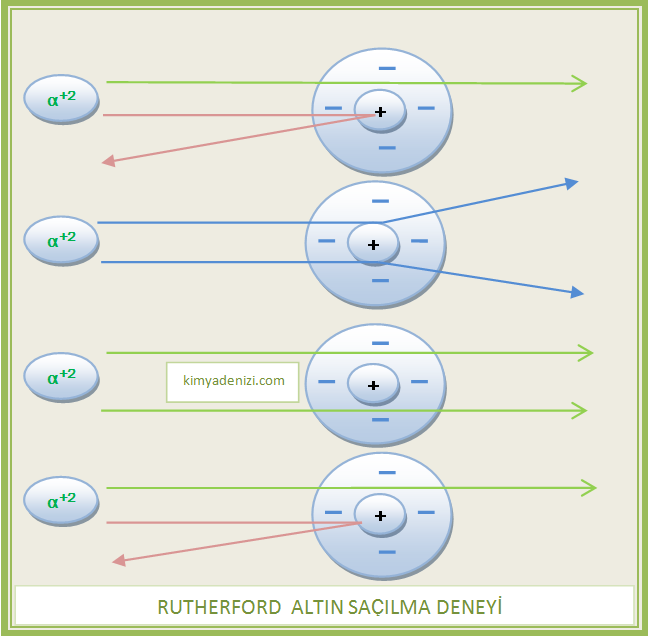
– Dar bir aralıktan, paralel ve pozitif(+2) yüklü Alfa tanecikleri demetini arkasına Çinko Sülfür (ZnS) sürülmüş ince altın levhaya gönderdi ve altın levhada saçılmalarını gözlemledi.
– ALTIN SAÇILMA DENEYİ Altın levha üzerinde beliren parıldamaları ve sapmaya uğrayan taneciklerin açısal dağılımını rahat görmek için levhaların arkasına ZnS sürüldü ve mikroskop kullanıldı.
Thomson‘un dedikleri doğru ise;
.. + yüklü Işınlar gönderildiğinde atomun büyük bir kısmını oluşturan + yüklü taneciklere çarpacak,
– Aynı yükler birbirini iteceği için büyük bir sapma veya geri dönme olayı gerçekleşecekti.
Rutherdford Deneyleri Sonucu (Altın Saçılma Deneyi)
– Rutherdford yaptıkları deneylerde bunun gerçekleşmediğini gördü;
– Pozitif(+) yüklü taneciklerin büyük bir kısmının levhayı hiç sapmadan veya küçük açılarla saparak geçtiğini gözlemledi.
Çok az sayıda tanecik 180o ye kadar büyük açılarla saptı
– Alfa taneciklerinin(+) hemen hemen tümü metal levhadan sapmadan geçiyordu.
Demek ki atomun büyük bir kısmı boşluktan ibaretti. Thomson un dediği gibi içi dolu küreler değildi
– Elektronlara yakın yol izleyen alfa parçacıkları hafif sapmaya uğruyordu.
– Çekirdeğe yakın yol izleyen alfa parçacıkları büyük bir açıyla sapıyordu.
– Çok az parçacık ise geniş açılarla sapıyor (1/22.000) veya tam geri dönüyordu.
Rutherford bu sapmayı ‘’bir top mermisinin ince bir kâğıda çarpıp geri dönmesi’’ olayına benzetmişti
– Demek ki + yükler Thomson un dediği gibi atom hacminin büyük bir kısmını değil çok küçük bir kısmını oluşturuyorlardı
Rutherford atom modelinin thomson atom modelinden ne gibi farklılıkları vardır ? Rutherford atom modeli özellikleri nelerdir? sorularına aşağıdaki maddeleri inceleyerek cevap bulabiliriz
Rutherford Atom Modeli Özellikleri Varsayımları
Ernest Rutherford Rutherford yaptığı deney sonucunda 1911’de kendi adı ile anılan bir atom modeli geliştirdi.
Rutherford Atom Modeli ni kısaca maddeler halinde özetleyecek sıralayacak olursak;
– Alfa parçacıklarının çoğu hiçbir sapmaya uğramadığına göre atomun büyük bir kısmı boşluktur.
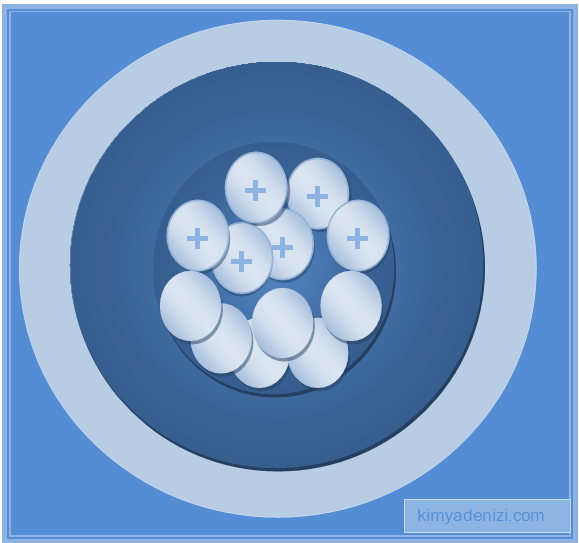
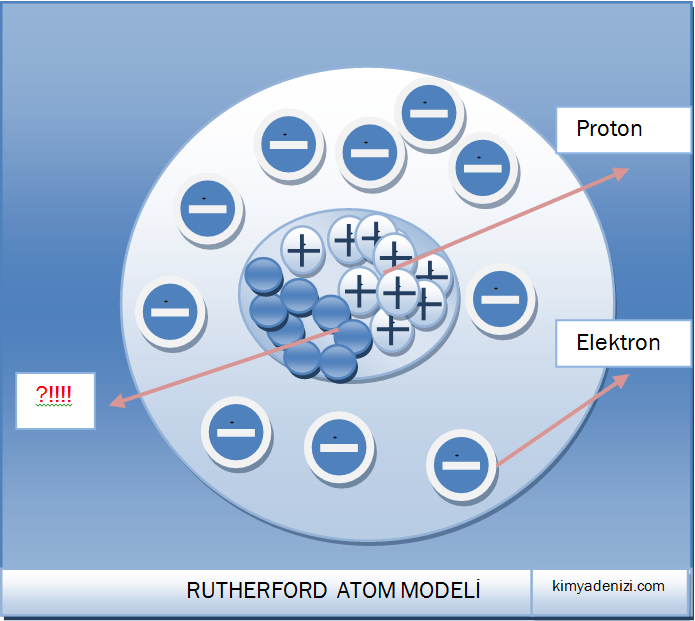
– Elektronlar çekirdeğin etrafında geniş boşluklar bırakacak şekilde dağılmış hâldedir.
– Atomda pozitif yükün tümü, küçük ama ağır kütleli Çekirdek denilen küçük bölgede toplanmıştır.
– Atomun kütlesinin de çoğu çekirdektedir.
– Elektronlar, atom içinde yaklaşık olarak 10-8 cm çapında bir hacmi kapladığı hâlde, pozitif elektrik çok küçük olmakla birlikte ağır bir çekirdek içinde toplanmıştır (10-13 cm) .
– Çekirdek, elektronların yüklerini dengeleyecek kadar pozitif yük taşımaktadır.
– Atomlar nötr olduğundan , elektronlar pozitif yüklere eşit sayıdadır.
– Elektronlar çekirdek etrafında bulunur (Yörünge kavramından bahsedilmiyor)
– Çekirdeğin çapı atomundakinden yaklaşık 100,000 kez daha küçüktür
– Pozitif yüklerin toplam kütlesi atomun kütlesinin yaklaşık yarısı kadardır.
– Çekirdekte protonun kütlesine eşit yüksüz tanecikler olmalıdır.(yüksüz tanecik olan nötronların varlığından bahsediyor)
– Alfa taneciklerinin saçılma deneyinde , sadece çekirdek bulunmamış çekirdeğin yükü ve büyüklüğü de nicel olarak ölçülmüştür..
– Rutherford’ un öngördüğü modelde elektronlar pozitif yüklü küre etrafında merkezkaç kuvveti (FM) ve Coulomb kuvvetlerinin (FC) dengesi altında dönerler.
Rutherford atom modelinin yetersizliği, eksiklikleri, yanlışları ve hataları var mı?Rutherford atom modeli neyi hangilerini açıklamada yetersiz kalmıştır?
– Rutherford atom modeli atomla ilgili bir çok şeye çözüm getirse de bazı eksikler bulunmaktadır
– Modelde öngörülen yörüngelerde ivmeli bir hareket yapan elektronlar Klasik Elektromagnetizma kanunlarına göre ışıma yapmalıydı ve bir süre sonra enerjisi tükenen elektron çekirdek üzerine düşecekti
– ‘’Elektronun neden çekirdeğe düşmüyor’’ ya da ‘’Elektronlar neden atomdan fırlayıp gitmiyor’’ sorularını cevaplayamamıştır. Bu sorular 1913 yılında Bohr Atom Modeli ile cevaplanmıştır.
– Rutherford atom modeli, atomların yaydığı spektrumları açıklamada da yetersiz kalmıştır
– Elektronlar çekirdek etrafında bulunur dedi ama Yörüngelerden hiç bahsetmedi.
– Rutherford’un çalışmaları sonucunda ulaştığı önemli bir öngörüsü; çekirdekte pozitif taneciklere eş kütlede yüksüz tanecikler bulunduğunu söyledi . Ama bu yüksüz taneciklerin (nötronların) varlığı 1932de James Chadvvick (CeymisÇedvik) tarafından kanıtlanmıştır.
Rutherford Atom Modeli Özet,
NELER VAR
Atomun büyük kısmı boşluktur, içi dolu küreler değildir!
+ ve – yükler homojen dağılmamıştır
ÇEKİRDEK var
+ yükler ÇEKİRDEK denilen küçük bir bölgede toplanmıştır
– yükler çekirdek etrafında dağılmışlardır
Nötrondan bahis var
Çekirdekte proton kütlesine eşit yüksüz tanecikler bulunmalıdır
NELER YOK
Yörünge yok
e–lar neden atomun dışına fırlamıyor?????
e–lar neden çekirdeğin üstüne düşmüyor????
atomların yaydığı spektrumlar Yok