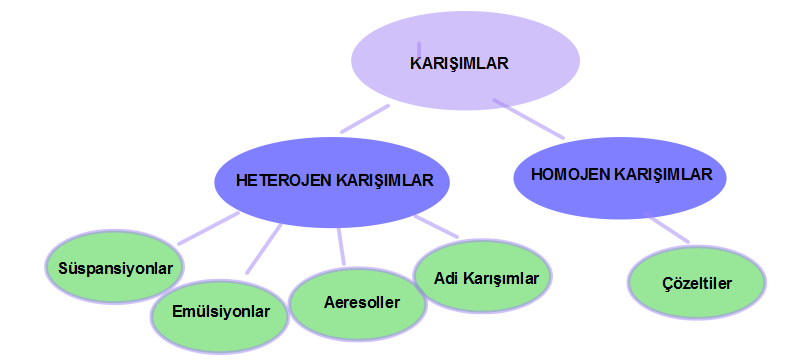
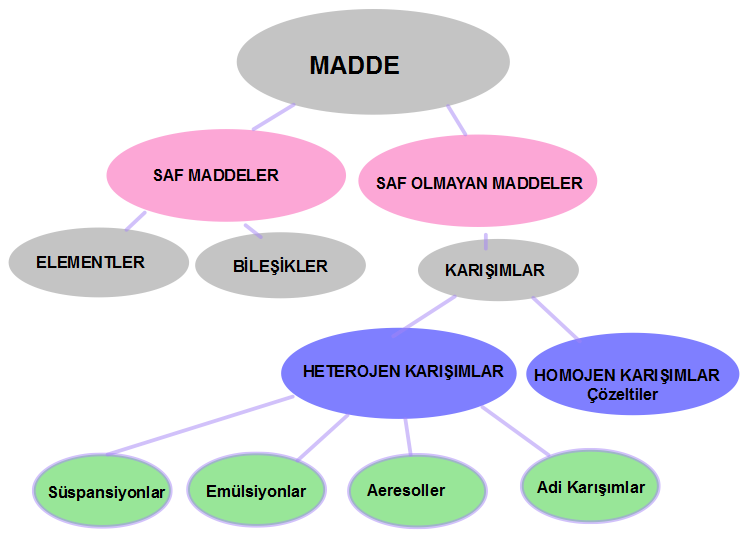
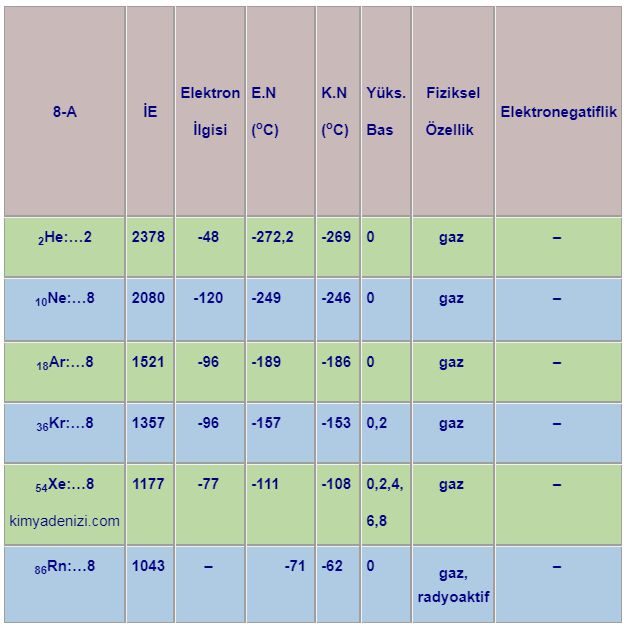
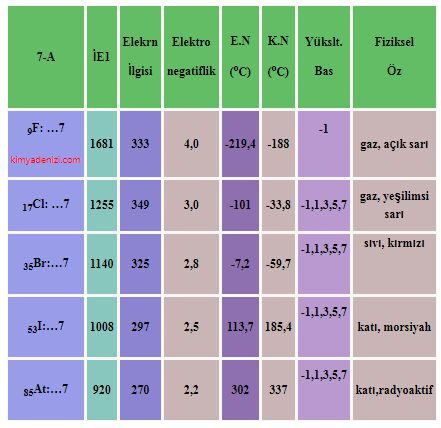
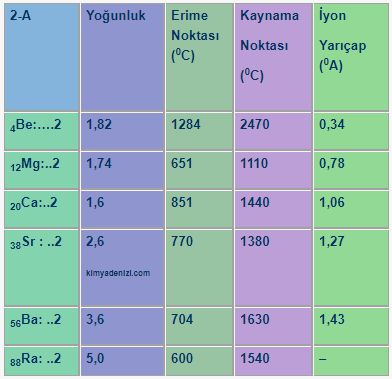
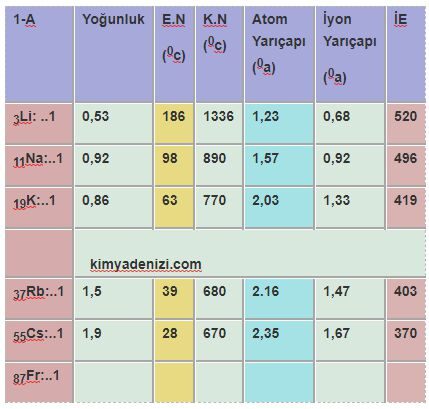
Saf Olmayan Maddeler Karışımlar ve Türleri Sınıflandırılması Homojen Karışımlar Heterojen Karışımlar
Saf Olmayan Maddeler Karışımlar ve Türleri Sınıflandırılması Homojen Karışımlar Heterojen Karışımlar Saf olmayan maddeler Karışımlar olarak adlandırılır. Karışımların Özellikleri ; Yapılarında iki yada daha fazla madde bulundururlar. Saf değildirler. Homojen veya heterojen olabilirler. Erime ve kaynama noktaları sabit değildir.(Belli koşullarda) Yoğunlukları sabit değildir.( Belli koşullarda) Yapı taşları element yada moleküller olabilir Fiziksel olarak karışırlar.oluşurlar. Kendini… Daha fazlasını oku »Saf Olmayan Maddeler Karışımlar ve Türleri Sınıflandırılması Homojen Karışımlar Heterojen Karışımlar