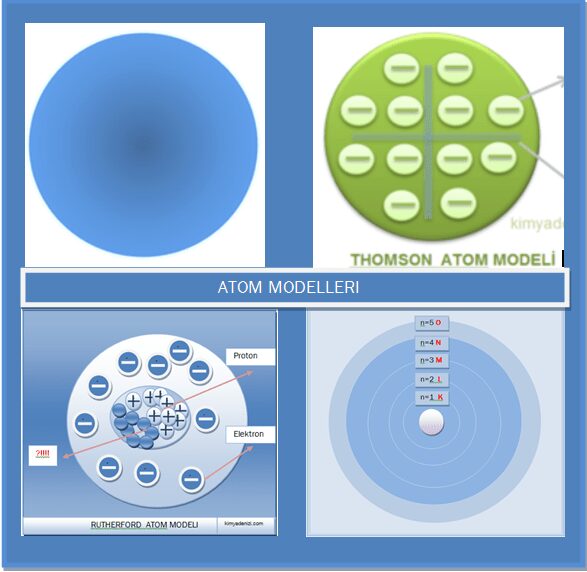
THOMSON ATOM MODELİ Üzümlü Kek Modeli Özellikleri Doğruları Eksiklikleri Varsayımları Yanlışları
Üzümlü Kek Modeli olarak da bilinen Thomson Atom Modeli 1897 yılında Joseph John Thomson tarafında ortaya atılmıştır.1897 yılında Joseph John Thomson, katot ışınlarıyla deneyler yaptı ve sonrasında Thomson Atom Modeli ni ortaya çıkardı.
– Thomson ; Katot ışınlarıyla yaptığı deneylerde, “katot ışınlarının, negatif kutup tarafından iletildiğini ve pozitif kutba doğru çekildiğini gözlemledi.”
– Deneylerin sonucuna göre, katot ışınları ona göre negatif yüklü olmalıydı. Thomson Negatif yüklü bu taneciklere “elektron” ismi verildi.
– Thomson, yapmış olduğu deneylerde elektronun yükünü ve kütlesini hesaplayamamış, ancakyük/kütle oranını hesaplamıştır.
– Elektronun kütlesi çok küçük olduğu için , atomun kütlesini belirleyen pozitif yüklerin kütlesi olmalıydı. Atomun hacminin büyük bölümünü pozitif yük oluşturmalıydı.
– Ona göre atom; çapı yaklaşık 10-8 cm olan, içi dolu, çok küçük küreciklerdi.
– Bu küreciğin ana gövdesi, pozitif yüklerden oluşuyor, elektronlar ise düzenli bir şekilde bu küreciğin içinde dağılmıştı.
THOMSON ATOM MODELİ Özellikleri Varsayımları
Thomson Atom Modelini kısaca özetle maddeler halinde sıralayacak olursak :
– Atom, yarıçapı 10-8 cm olan içi dolu, nötr, küreciklerdir.
– Bu küre içersinde elektronlar, kararlı bir elektrostatik düzen oluşturacak şekilde dağılmışlardır.
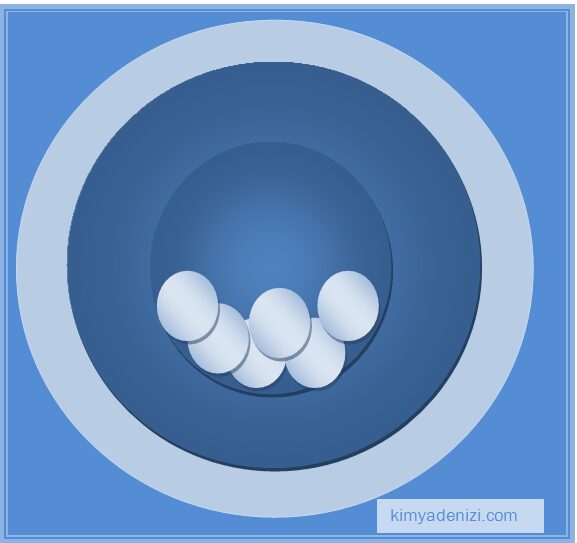
– Atomun pozitif (+) yükünü dengeleyecek kadar negatif yük atomun içerisinde (üzümler gibi) homojenolarak dağılmıştır
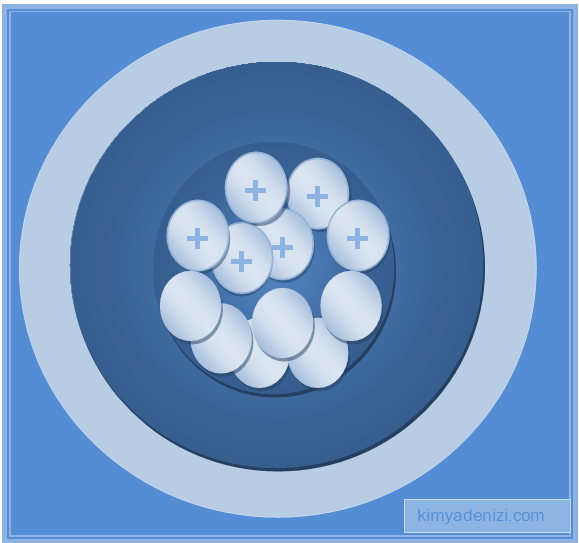
– Pozitif yükler, bu küreciğin gövdesini oluşturmaktadır.
– Atomun (kekin ana kısmı) pozitif (+) yüklü taneciklerden oluşmaktadır.
– Atomlarda pozitif yük sayısı kadar negatif yük vardır. Yani (+) ve (-) yükler eşittir. Bu nedenle atomlar nötrdür.
– Elektronların kütlesi, atomun kütlesi yanında ihmal edilebilecek kadar küçüktür.
– Atomun kütlesini büyük ölçüde pozitif yükler teşkil etmektedir
Thomson Atom Modelinin eksiklikleri ve yanlışları varmı?
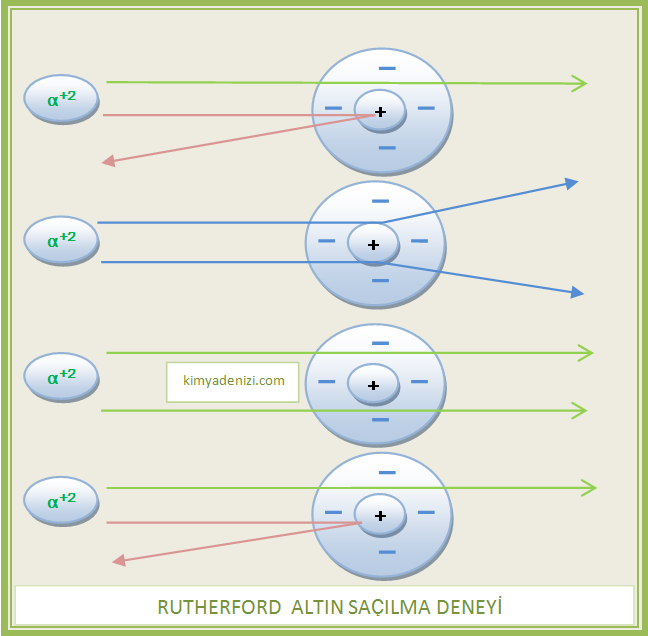
– Thomson atom modelinde (+) yüklerin ve (-) yüklerin atomda homojen olarak dağıldığı iddiası yanlıştır.
– Atomların gövdesi, pozitif yüklü taneciklerden oluşmamaktadır.Pozitif yüklü tanecikler çekirdek denilen çok küçük bir bölgede bulunmaktadır
– Elektronlar atom üzerinde rastgele dağılmamışlardır,enerjilerine göre yörüngelerde bulunurlar
Joseph John Thomson Elektron Keşfine Katkıları(1897);
– Plücker’in çalışmalarını havası daha iyi alınmış katot tüplerinde hem manyetik alan ve hem elektrik alan uygulayarak tekrarladı.
– Bu kadar küçük taneciğin atom olamayacağını bu maddenin elektron olduğunu ispat etti.Böyledce J.J. Thomson 1897 yılında elektronu keşfetti.
– Negatif yüklü taneciklere elektron adını Stoney vermiştir. Thomson vermemiştir..
– 1897 yılında, J.J.Thomson, katot ışınlarından Elektronun yük/kütle (e/m) oranlarını hesapladı.
– Kasım ayında, WillyWien, Thomson’un bulgularını doğruladı.
– MİLİKAN(1913); Yağ damlası deneyiyle 1 Elektronun yükünü hesapladı.
– Milikan Elektronun yükünün bulunmasından sonra Thomson’un e/m değerini kullanarak elektronun kütlesini hesapladı.
Elektronun Kütlesi Ve Yükünün Bulunması
– 1858’de Julius Plücker (Julyüs Plüker), katot tüpünün yakınına bir mıknatıs getirerek oluşan katot ışınlarını gözlemleyip bu ışınların manyetik alandaki davranışlarını ilk kez inceleyen bilim insanıdır.
– Katottan çıkan elektronlar anota doğu hareket eder.
– Anotta şekildeki gibi bir delik açılırsa elektronlar delikten geçerek floresan boya ile kaplı yüzeye çarpar. Böylece ışıklı bir nokta görülmesine neden olur.
– Tüpe, elektriksel alan uygulanırsa yani tüpün altına ve üstüne zıt elektrikle yüklenmiş levhalar (saptırıcı levhalar) konursa elektronların artı yüklü levhaya doğru saptığı ve yüzeye çarptığı görülür.
– Yüklü bir parçacığın elektriksel alanda sapma miktarı, parçacığın elektrik yükü ile doğu orantılıdır. Diğer taraftan kütlesi ile ters orantılı olması gereği de açıktır. Çünkü büyük kütleli bir parçacık, yüklü levhaların oluşturduğu elektrostatik çekimden daha az etkilenecektir.
– Elektriksel alana dik olacak şekilde bir manyetik alan uygulanırsa elektronlar eğimli bir yol çizerek tüpün yüzeyine çarpar.
– Thomson, deneylerinde elektriksel alana dik belli bir şiddetle manyetik alan uygulayarak elektron demetinin sapmasını ölçmüştür. Ayrıca elektriksel alan da uygulayarak sapmayı durdurmuştur
– 1897 yılında J.J. Thomson, katot ışınlarının elektriksel alanda pozitif kutba yöneldiğini gördü.
– Bu yönelmeden yararlanarak yük/kütle oranını belirledi.
– (e/m=-1,7588. 108 C/g). Hızlarını ölçtü ve elektronların tüm atomların yapısında olduğunu kanıtladı.
– Thomson; Elektriksel ve manyetik alanların şiddetlerinden yararlanarak elektronlar için ;
Thomson (yük/kütle) e/m oranını;
–1,7588 x 10 11 C/kg
-1,7588.108 C/g
olarak bulmuştur.
Milikan Deneyi Elektronun Yük Ve Kütlesinin Bulunması
– Elektron yükü 1908’de Rabert Andrews Millikan (Rabıt Endruv Milikan) tarafından ölçülmüştür. Elektrik yükü şekildeki düzenek ve e/m değeri kullanılarak hesaplanmıştır.
– Deneyde pülverizatör (püskürteç) den püskürtülen küresel yağ damlacıkları, kabın üst bölümüne gönderilir.
– Sis halinde dağılmış küçük yağ damlacıkları, üst levhadaki delikten aşağı inerken bu damlacıklara X-ışınları gönderilir.
– Bu ışınların ortamdaki havayı oluşturan (N2 ve O2) moleküller ile çarpışarak kopardığı elektronlar, yağ damlacıkları tarafından tutulur ve damlacıklar negatif yüklenir.
– Üst plaka pozitif (+), alt plaka negatif(-) yüklenirse negatif yüklü yağ damlacıklarının düşmesi durdurulabildiği gibi damlacıkların yukarıya hareket etmesi de sağlanabilir.
– Damlacığın davranışları ve düşme hızı, elektriksel alan yokluğunda (akım uygulanmadığında), mikroskopta gözlemlenerek bulunabilir.
– Damlacığın düşüşünü durdurmak için uygulanacak yük miktarı bilinirse her damla üzerindeki yük de hesaplanabilir
– Milikan deneyi tekrarladığında yağ damlacıkları üzerindeki yükün en büyük ortak böleninin (ebob) daima -1,6022×10-19 Coulomb değerini verdiğini görmüştür.
Bunun sonucunda, yağ damlalarının birden fazla elektron taşıdıkları ve bir yağ damlası üzerindeki yükün tek bir elektron yükünün katları olması gerektiği sonucuna varmıştır.
Milikan elektronun yükünü e=-1,6022×10-19 C olrak bulmuştur
thomson yük /kütle değeri e/m=-1,7588. 1011 C/kğ idi
m=9,1096.10-31 kğ
m=9,1096.10-28 gr
– Millikan, bir elektron yükünü -1,6022×1019 C olarak belirledikten sonra Thomsonun e/m değerinden faydalanarak 1 elektronun kütlesini hesaplamıştır.
THOMSON ATOM MODELİ ÖZET
Atomlar çapları yaklaşık 10-8 cm olan, içi dolu, çok küçük küreciklerdi
İlk tanecikli atom modelidir.Proton ve elektron var
Proton ve elektronlar homojen dağılmıştır
yük/kütle oranı var Ama yük ve kütle değerleri yok
Yörünge yok
Nötron yok
etiket arama yazıları
Elektronu keşfeden kişi Thomson sayılır.(Diğer bilim adamlarının katkıları olsa da en ciddi bulgular Thomson a aittir.
Elektronun yük/kütle oranını bulan kişi Thomson dur
Elektronun yük kütle oranını bulan kişi Thomson dur
THOMSON (yük/kütle) e/m oranını -1,7588 x 10 11 C/kg =-1,7588.108 C/g olarak bulmuştur
elektronun yükünü bulan bilim adamı Millikan dır
elektron yükü kaç coulomb? elektron yükü-1,6022×10-19 C dur
elektronun kütlesini hesaplayan bilim adamı Millikan dır
elektronun kütlesini milikan m=9,1096.10-28 gr olrak bulmuştur
elekron adının verilmesini öneren bilim adamı Stoney dir