ELEKTRON İLGİSİ Nedir? Elektron İlgisi Sıralaması Soruları Grup Sıralaması
Elektron İlgisi Nedir? Tanımı
Elektron ilgisi, gaz hâldeki bir atomun bir elektron alması sırasında oluşan enerji değişimidir. Elektron ilgisi, bir elementlerin elektron almaya ya da almamaya olan eğilimlerinin ölçüsüdür.Birimi genelde kJ/mol KiloJoule/mol) cinsindendir.
F (g) + e– → F–(g+ 78,4 kkal Eİ=- 78,4 kkal
Cl(g)) + e– → Cl–(g) + 83,4 kkal Eİ=- 83,4 kkal
Br(g) + e–→Br–(g) + 77,6 kkal Eİ= -77,6 kkal
Atoma yaklaşan elektron atoma ait elektron bulutu tarafından itilirken çekirdek tarafından çekilir. Çekme itmeden büyük olursa enerji açığa çıkar.Bu enerji elektron ilgisidir.
| 1A |
| 8A | |||||||||||
| H | He | ||||||||||||
| -73 | 2A | 3A | 4A | 5A | 6A | 7A | 21 | ||||||
| Li | Be | B | C | N | O | F | Ne | ||||||
| -60 | 240 | -27 | -122 | ~ +9 | -140 | -333 | 29 | ||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||
| -53 | 230 | -44 | -34 | -72 | -200 | -349 | 35 | ||||||
| K | Ca | Ga | Ge | As | Se | Br | Kr | ||||||
| -48 | 156 | -30 | -120 | -77 | -195 | -325 | 39 | ||||||
| Rb | Sr | In | Sn | Sb | Te | I | Xe | ||||||
| -47 | 168 | -30 | -121 | -101 | -190 | -297 | 41 | ||||||
| Cs | Ba | Tl | Pb | Bi | Po | At | Rn | ||||||
| -45 | 52 | -30 | -110 | -110 | -180 | -270 | 41 | ||||||
 9.SINIF KİMYA KAZANIM TESTLERİ ÇÖZÜMLERİ İÇİN TIKLA
9.SINIF KİMYA KAZANIM TESTLERİ ÇÖZÜMLERİ İÇİN TIKLA
7A grubu Halojenler Elektron İlgileri En Fazladır (7a grubu elektron ilgisi),
7A grubunda bulunan elementlerin dış katman p orbitallerinde 5e– bulunur. 1e– aldıklarında asal gaz elektron dizilimine benzeyecekleri için elektron ilgileri büyüktür. Bu tür atomlar elektron almak için enerjiye ihtiyaç duymadıkları gibi elektron aldıklarında da enerji açığa çıkarırlar.Atoma yaklaşan elektron atoma ait elektron bulutu tarafından itilirken çekirdek tarafından çekilir. Çekme itmeden büyük olursa enerji açığa çıkar.Bu enerji elektron ilgisidir.
Elektron İlgisi Pozitif Olabilir mi Yoksa Hep Negatif midir?
» Elektron ilgisi pozitif veya negatif olabilir. Örneğin, F atomunun elektron ilgisi negatifken N atomunun elektron ilgisi pozitiftir
» Ametallerin elektron ilgileri N hariç, negatiftir. N=+9 KJ
»Periyodik sistemde 7A grubu elementleri en büyük elektron ilgisine sahip iken metallerin ve asal gazların elektron ilgileri çok küçüktür.
Metallerin elektron ilgileri ve soy gazların elektron ilgileri var mıdır?
— Metallerin ve soy gazların elektron ilgileri yok kabul edilir.
— 1A grubu elementleri Metal oldukları halde elektron ilgileri vardır.
Klor un elektron ilgisi Flor un elektron ilgisinden daha büyüktür ( f ve cl elektron ilgisi )
Periyodik tabloda, aynı grupta, yörünge sayısı arttıkça; elektron ilgisi genellikle azalır. Ancak F < Cl dur.
— 9F’un boş değerlik orbitali yok buna karşılık,Klor 17Cl’un boş değerlik orbitali çoktur. Flor F ‘a elektronu yerleştirmek için daha fazla enerji harcanması gerekiyor. Bu sebeple Cl ‘un elektron ilgisi daha büyüktür.Klor Cl ‘un elektron ilgisi Flor dan daha büyüktür.
Elektron İlgisi Periyodik Cetvelde Nasıl Değişir, elektron ilgisi grup sıralaması,
Periyodik tabloda, aynı grupta, yörünge sayısı arttıkça; elektron ilgisi genellikle azalır.
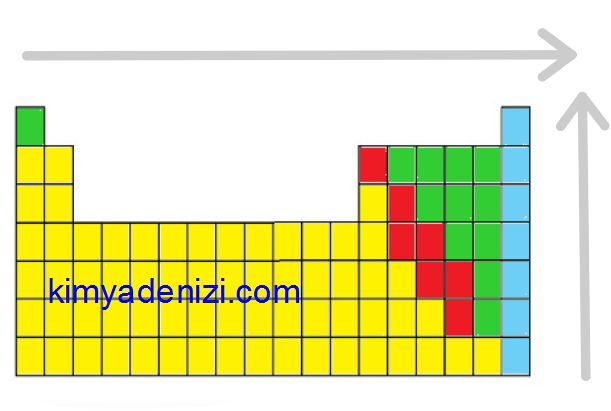
Periyodik sistemde aynı grupta aşağıdan yukarıya veaynı peryotte soldan sağa doğru gidildikçe elektron ilgisi artar,.
Peryodik Cetvelde;
Soldan Sağa Elektron İlgisi Artar
Aşağıdan Yukarıya Elektron İlgisi Artar
Elektron İlgisi Artar
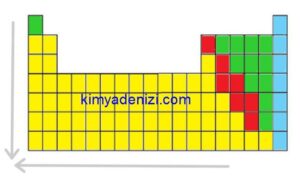
PERYODİK CETVELDE;
Sağdan Sola Elektron İlgisi Azalır
Yukarıdan Aşağıya Elektron İlgisi Azalır
Elektron İlgisi Azalır
.
.