Atom Hacmi Atom Yarıçapı Nedir Karşılaştırma Tanımı Çözümlü Örnek Sorular Çapı
Atom Yarıçapı
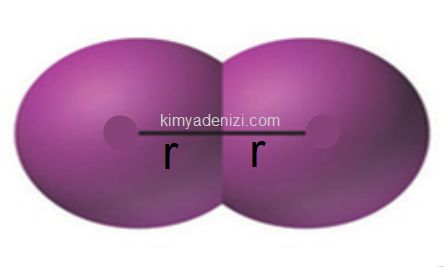
Atom yarıçapı iki atomun çekirdekleri arasındaki uzaklığın yarısıdır..Farklı tanımlar olsa da ” iki atomun çekirdekleri arası uzaklığın yarısına atom yarıçapı denir ” tanımı en genel tanımdır.
»» Elektronlar dalga hareketi yaparlar bu nedenle,atomların büyüklükleri tam olarak hesaplanamaz.
»» Metallerde yan yana duran iki metal atomunun çekirdekleri arasındaki uzaklığın yarısıdır.
»» Ametallerin oluştuğu O2 gibi moleküllerde iki atomun çekirdekleri arasındaki uzaklığın yarısıdır.
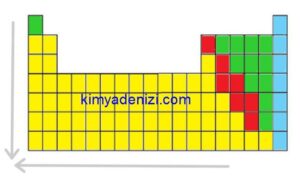
⇒ Bir periyotta soldan sağa doğru gidildikçe elektron başına düşen çekim kuvveti artar , atom yarıçapı küçülür.
⇒Bir grupta yukarıdan aşağıya doğru inildikçe yörünge sayısı arttığı için atom yarıçapı artar ve atom hacmi büyür
⇒Periyodik sistemin aynı grubunda yukarıdan aşağıya doğru çekirdek yükü artar. Dış katman elektronları, çekirdekten daha uzakta bulunur. Böylece atomun çekirdeğinin elektronu çekme gücü zayıflar, atom yarıçapı artar.
 9.SINIF KİMYA KAZANIM TESTLERİ ÇÖZÜMLERİ İÇİN TIKLA
9.SINIF KİMYA KAZANIM TESTLERİ ÇÖZÜMLERİ İÇİN TIKLA
Peryodik Cetvelde Atom Yarıçapı Değişimi
Atom Yarıçapı sağdan sola artar mı yukarıdan aşağıya artar mı Peryodik cetvelde nasıl değişir?
Genel olarak Peryodik cetvelde;
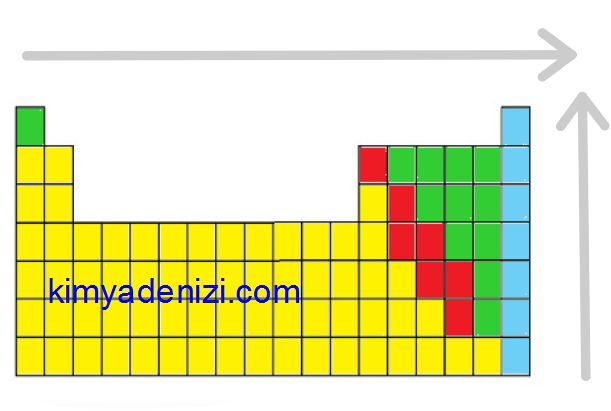
Sağdan Sola Atom Yarıçapı ARTAR
Yukarıdan Aşağıya Atom Yarıçapı ARTAR
Atom yarıçapı artar
Peryodik cetvelde;
Soldan Sağa Atom Yarıçapı Azalır
Aşağıdan Yukarıya Atom Yarıçapı Azalır
Atom yarıçapı azalır
ATOM YARIÇAPI ÖRNEKLER Çözümlü Sorular
Örnek:
2He, 10Ne , 18Ar atom yarıçaplarını karşılaştırınız.
| 1.K | 2.K | 3.K | |||
| 2He | 2 | 1.Peryot | 8-A | ||
| 10Ne | 2 | 8 | 2.Peryot | 8-A | |
| 18Ar | 2 | 8 | 8 | 3.Peryot | 8-A |
| kimyadenizi.com | |||||
2He, Des 2 ama 8A grubundadır..İSTİSNA….
Üçü de 8-A grubunda
Grup no ları aynı ise yani aynı grupta isler;
Katman sayısına bakılır
Katman sayısı büyük olanın olanın yarıçapı daha fazladır
18Ar > 10Ne > 2He
8A 8A 8A
Ya da daha kısa bir şekilde;
Aynı grupta aşağıya doğru çap artar diyebiliriz
AYNI GRUPTA
Örnek:
4Be, 12Mg ,20Ca atom yarıçaplarını karşılaştırınız.
| 1.K | 2.K | 3.K | 4.K | Katman sayısı (Peryot No) | ||
| 4Be | 2 | 2 | 2.Peryot | 2-A | ||
| 12Mg | 2 | 8 | 2 | 3.Peryot | 2-A | |
| 20Ca | 2 | 8 | 8 | 2 | 4.Peryot | 2-A |
Üçünün de sonu 2 ile biter ,Aynı grup demektir,2-A grubu
Alt alta gelirler.
Grupta yukarıdan aşağıya doğru yarıçap artar
Yani aynı grupta katman sayısı fazla olanın yarıçapı daha fazladır
20Ca > 12Mg > 4Be
4K 3K 2 Katmanlı
AYNI GRUPTA
Örnek:
12Mg, 16S ,18Ar atom yarıçaplarını karşılaştırınız.
| 1.K | 2.K | 3.K | |||
| 12Mg | 2 | 8 | 2 | 3.Peryot | 2-A . |
| 16S | 2 | 8 | 6 | 3.Peryot | 6-A |
| 18Ar | 2. | 8 | 8 | 3.Peryot | 8-A |
Üçü de 3 katmanlı yani 3. Peryotta
Aynı peryotta sağdan sola doğru yarıçap artar
| 12Mg | …….. | 16S | 18Ar |
![]()
Sola doğru yarıçap artar
12Mg> 16S >18Ar
AYNI PERYOTTA
Örnek:
12Mg, 13Al ,18Ar atom yarıçaplarını karşılaştırınız.
| 1.K | 2.K | 3.K | Katman sayısı (Peryot No) | ||
| 12Mg | 2 | 8 | 2 | 2.Peryot | 2-A |
| 13Al | 2 | 8 | 3 | 3.Peryot | 3-A |
| 18Ar | 2 | 8 | 8 | 3.Peryot | 8-A |
Üçü de 3 katmanlı yani 3. Peryotta
Aynı peryotta sağdan sola doğru yarıçap artar
| 12Mg | 13Al | 18Ar |
![]()
Sola doğru yarıçap artar
12Mg> 13Al >18Ar
2-A 3-A 8-A
AYNI PERYOTTA
NOT:
İyonlaşma enerjisindeki 2A 3A ve 5A 6A istisnasına yarıçapta bakılmaz.
Φ Atom yarıçapı arttıkça doğal olarak atom çapı, atom hacmi ve atom büyüklüğü de artar
ΦYukarda verilen maddelerle yalnızca AYNI GRUPTA veya AYNI PERYOTTA iseler karşılaştırma yapabiliriz.
Ama farklı peryotlarda iseler veya farklı gruplarda iseler karşılaştırma yapamayız
Aşağıdaki kurallarla peryodik cetvelin herhangi bir yerindeki atom veya iyonlarda genel olarak karşılaştırma yapabiliriz
Atom Yarıçapları Karşılaştırma Atom Çaplarının ve Atom Hacimlerinin Kıyaslanması
»» Katman sayısına bakılır,Katman sayısı büyük olanın çapı hacmi va atom yarıçapı daha büyüktür..
7N10-3:2.8.8 2 katmanlı (2.peryot)
19K19: 2.8.8.1 4 katmanlı (4.peryot)
11Na11:2.8.1 3 katmanlı (3.peryot)
19K > 11Na> 7N-3
»» Katman sayısı eşitse, değerlik elektron sayısına bakılır.
Değerlik elektron sayısı küçük olanın atom yarıçapı daha fazladır.
11Na11 : 2. 8. 1 3 katmanlı Des:1
12Mg12 : 2. 8. 2 3 katmanlı Des:2
16S18-2: 2. 8. 8 3 katmanlı Des:8
Katman sayıları eşit (Hepsi 3 katmanlı) değerlik elektron sayısına bakılır.
Değerlik elektron sayısı büyük olan 16S18-2 dir
16S18-2 >12Mg12 >11Na11
»»Hem katman ve hem de değerlik elektron sayısı eşitse;
Proton sayısı küçük olanın atom çapı daha büyüktür. Ya da başka bir şekilde p/e oranı az olanın atom çapı daha büyüktür
Yani e başına düşen çekim arttıkça çap azalmıştır.Bu tür atom ve iyonlarda p/e oranına bakılır;
p/e oranı fazla ise Çekim daha fazla, çap daha az demektir..
17Cl18-1 : 2. 8. 8 3 katmanlı Des:8
18Ar18: 2. 8. 8 3 katmanlı Des:8
19K18+1 : 2. 8. 8 3 katmanlı Des:8
17Cl18-1 >18Ar18> 19K18+1 Atom yarıçapı
p/e 17/18 < 18/18 < 19/18 Çekim kuvveti
p/e oranı en küçük olan p/e =17/18 çekimi en azdır, çapı da en büyüktür (17Cl18-1 )
Örnek:
11Na10+>12Mg102+>13Al103+ Atom yarıçapları
p/e 11/10 =1,1 < 12/10=1,2 < 13/10 =1,3 Çekim Sıralaması
Çekimi en fazla olan p/e si en fazla olandır.yani 1,3 ile 13Al103+dir
Çapı en fazla olan p/e si en az olandır.yani 1,1 ile 11Na10+
Örnek:
15P18-3 > 16S-218 > 17Cl-118 Atom yarıçapları
p/e 15/18 < 16/18 < 17/18 Çekim Sıralaması
p/e en küçük olan p/e =15/18 çekimi en azdır ,çapı da en büyüktür (15P18-3)
15Pl18-3 için 1 e başına düşen çekim kuvveti;
18e başına düşen 15 proton çekimi
1e başına düşen x .
x=15/18 proton çekimi düşer
- p/e oranına her zaman bakılmaz izoelektronik atomlarda bakılır.
Bir atom elektron aldıkça çapı büyür. (- yüklü olursa)
X-3 >X-2 >X-1 >X0
Elektron verdikçe çapı küçülür. (+yüklü olursa)
X0>X+1 >X+2 >X+3

11Na11 > 11Na10+


12Mg12 > 12Mg102+




Yük arttıkça atom çapı azalır
X-3 >X-2 >X-1 >X0>X+1 >X+2 >X+3
Örnek:
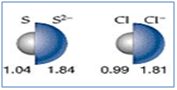 Atom yarıçaplarını karşılaştırınız.
Atom yarıçaplarını karşılaştırınız.


16S18-2 >16S16 17Cl18-1 >17Cl17
16S18-2 >17Cl18-1 >16S16 >17Cl17
Örnek:
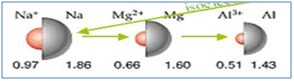
Atom yarıçaplarını karşılaştırınız.
11Na10+<11Na11 12Mg102+ <12Mg12 13Al103+ <13Al13
11Na11 >12Mg12 > 13Al13 > 11Na10+>12Mg102+ >13Al103+
Örnek:
11Na..12Mg. . 11Na+ .12Mg2+
Atom yarıçaplarını karşılaştırınız.
11Na11 >12Mg12 > 11Na10+ >12Mg102+
Atom Yarıçapı Çözümlü Örnek Sorular
Soru:
4Be, 16S, 15P , 19K atom yarıçaplarını karşılaştırınız.
| 1.K | 2.K | 3.K | 4.K | Katman sayısı (Peryot No) | ||
| 4Be | 2 | 2 | 2.Peryot | 2-A | ||
| 16S | 2 | 8 | 6 | 3.Peryot | 6-A | |
| 15P | 2 | 8 | 5 | 3.Peryot | 5-A | |
| 19K | 2 | 8 | 8 | 1 | 4.Peryot | 1-A |
16S ile 15P aynı peryotta
15P >16S
5-A 6A
Katman sayısı en fazla olanın yarıçapı en fazladır
19K > 15P > 16S >4Be
4K 3K 3K 2Katmanlı
Örnek:
7N, 8O , 20Ca atom yarıçaplarını karşılaştırınız.
| 1.K | 2.K | 3.K | 4.K | Katman sayısı (Peryot No) | ||
| 7N | 2 | 5 | 2.Peryot | 5-A | ||
| 8O | 2 | 6 | 2.Peryot | 6-A | ||
| 20Ca | 2 | 8 | 8 | 2 | 4.Peryot | 2-A |
7N ile 8O aynı peryotta
7N > 8O
5-A 6A
Katman sayısı en fazla olanın yarıçapı en fazladır
20Ca > 7N > 8O
4K 2K 2Katmanlı
Örnek:
7N, 9F, 11Na, 12Mg , 19K atom yarıçaplarını karşılaştırınız.
| 1.K | 2.K | 3.K | 4.K | Katman sayısı (Peryot No) | Grup No | |
| 7N | 2 | 5 | 2.Peryot | 5-A | ||
| 9F | 2 | 7 | 2.Peryot | 7-A | ||
| 11Na | 2 | 8 | 1 | 3.Peryot | 1-A | |
| 12Mg | 2 | 8 | 2 | 3.Peryot | 2-A | |
| 20Ca | 2 | 8 | 8 | 1 | 4.Peryot | 1-A |
7N ile 9F aynı peryotta, aynı katmanlı
7N > 9F
5-A 7A
11Na ile 12Mg aynı peryotta aynı katmanlı
11Na > 12Mg
1-A 2A
Katman sayısı yani peryot nosu en fazla olanın yarıçapı en fazladır
19K > 11Na > 12Mg > 7N > 9F
4K 3K 3K 2K 2Katmanlı
.
.