ASİDİK OKSİTLER Nedir? Örnekler Asit Oksitlerin Bazlarla Bazik Oksitlerle Tepkimesi
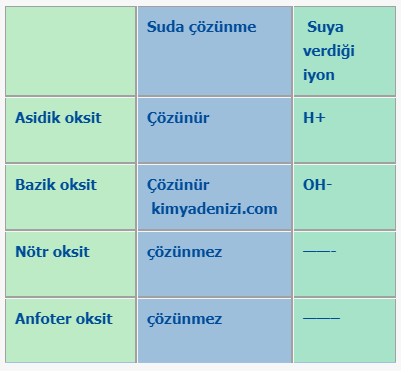
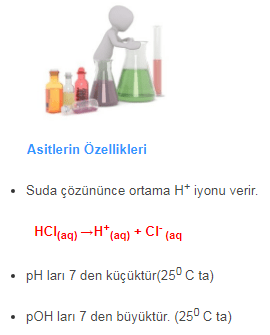
Asidik Oksitler Tanımı Nelerdir Örnekler Tepkimeleri Asidik Oksitler Nedir Tanımı Örnekler CO2, SO2, SO3, NO2, N2O3, N2O5, P2O5, CI2O7 gibi ametallerin Oksijen ile yaptıkları, O sayısının ametalden fazla olduğu polioksitlere Asidik oksitler veya asit oksit denir » Asidik Oksitler ametallerin oksijen ile yapmış olduğu,oksijen sayısının ametalden fazla olduğu polioksitleridir. Asidik Oksit Örnekler CO2, SO2, SO3,… Daha fazlasını oku »ASİDİK OKSİTLER Nedir? Örnekler Asit Oksitlerin Bazlarla Bazik Oksitlerle Tepkimesi