Elektronegatiflik Periyodik Cetvelde Elekronegatiflik Değişimi
- Elektronegatif lik, bir atomun kimyasal bağdaki elektronları kendine doğru çekme yeteneğinin bir ölçüsüdür.
- Elektronegatifliği yüksek olan elementler, elektronegatifliği düşük olan elementlere göre elektronları daha fazla kendilerine çekme eğilimindedirler.
Ör : HF molekülünde F nun elektronegatiflği daha yüksektir.Yani F atomu H atomunu kendine doğru daha çok çeker.
Elektro negatifliği az olan δ+ H+ Kendine az çeker
Elektro negatifliği fazla olan δ– F– Daha çok çeker.
δ+ δ–
H F
H → F Florun bağ elektronları daha çok çeker
Ör : H2O molekülünde O nun elektronegatiflği daha yüksektir.Yani O atomu H atomunu kendine doğru daha çok çeker.
δ+ δ – δ+
H → O ← H
- Elektro negatiflik; elektron ilgisi ve iyonlaşma enerjisiyle ilgili bir olaydır.
- Elektronegatiflikte, iyonlaşma enerjisi ve elektron ilgisinde olduğu gibi enerji alınıp verilmez.
- Elektronegatiflik bağdaki atomların birbirine göre elektronları çekme eğiliminin bağıl büyüklüğünü gösteren bir sayıdır.Mulliken Tanımı:
- Elektronegatiflik değeri doğrudan ölçülemediğinden bu değerin belirlenmesi için çeşitli yaklaşımlar öne sürülmüştür. Bunlardan önemlileri; 1932 yılında Pauling (Paulink) ve 1934 yılında Mulliken (Muliken)’in öne sürdüğü yaklaşımlardır
- Elektronegatifliğin kimyada bir çok uygulaması olduğu görülür. Bunların başında;
- Bağ enerjilerinin irdelenmesi,
- Bağ ve molekül polarlığının öngörülmesi,
- Elementlerin katıldığı tepkime türlerinin açıklanmasıgibi uygulama alanları gelir.
- Pauling, elektronegatifliği farklı olan atomların yaptığı bağların daha sağlam olduğunu gözlemiştir.
O hâlde bağın sağlamlığını etkileyen faktörlerden bir tanesi atomların bağ enerjisi; diğeri ise atomların birbirini çekme gücüdür.
- Bir atom yüksek elektron ilgisi (elektronları kolaylıkla alma eğilimi) ve yüksek iyonlaşma enerjisine (elektronları zor verme eğilimi) sahipse, bir bileşik oluşurken elektron kazanır.
- Hem iyonlaşma enerjisi hem de elektron ilgisi düşükse, bu atom elektron kazanma yerine elektron kaybetme eğilimi gösterir.
- u bilgiler doğrultusunda elektronegatifliği iyonlaşma enerjisi ve elektron ilgisinin aritmetik ortalaması şeklinde düşünebiliriz ve aşağıdaki formülle gösterebiliriz.
Elektronegatiflik Hesaplama Formülü
- Bir atomun elektronegatifliği, o atomun iyonlaşma enerjisi ve elektron ilgisi değerlerinin ortalamasıdır.
Elektronegatiflik Hesaplama Formülü ;
Elektronegatiflik= (k. (İyonlaşma Enerjisi + Elektron İlgisi) / 2
- Pauling F’un elektronegatifliği 4 kabul edilmiştir. Diğer elementlerin elektronegatifliği buna kıyasla tespit edilmiştir.
H 2,1 |
| He | |||||||||||||||
Li 1,0 | Be 1,5 | B 2,0 | C 2,5 | N 3,0 | O 3,5 | F 4,0 | Ne | ||||||||||
Na 0,9 | Mg 1,2 | Al 1,5 | Si 1,8 | P 2,1 | S 2,5 | CI 3,0 | Ar | ||||||||||
K 0,8 | Ca 1,0 | Ga 1,6 | Ge 1,8 | As 2,0 | Se 2,4 | Br 2,8 | Kr 3,0 | ||||||||||
Rb 0,8 | Sr 1,0 | In 1,7 | Sn 1,8 | Sb 1,9 | Te 2,1 | I 2,5 | Xe 2,6 | ||||||||||
Cs 0,8 | Ba 0,9 | Tl 1,8 | Pb 1,8 | Bi 1,9 | Po 2,0 | At 2,2 | Rn | ||||||||||
Fr 0,7 | Ra 0,9 | ||||||||||||||||
BAZI ELEMENTLERİN ELEKTRONEGATİFLİKLERİ
Periyodik Cetvelde Elekronegatiflik Değişimi
- Periyodik cetvelde soldan sağa doğru ve aşağıdan yukarıya iyonlaşma enerjisi ve elektron ilgisi arttığı için elektronegatiflik de artar.
- Gruplarda ise yukarıdan aşağıya ve sağdan sola doğru iyonlaşma enerjisi ve elektron ilgisi azaldığından elektronegatiflik de azalır.
- Elektronegatiflikleri en yüksek olan elementler periyodik sistemin sağ üst köşesinde bulunan halojenler, oksijen, azot ve kükürttür. Elektronegatiflikleri en düşük elementler ise periyodik sistemin sol alt köşesinde bulunur.
PERYODİK CETVELDE;
Soldan Sağa Elektronegatiflik Artar
Aşağıdan Yukarıya Elektronegatiflik Artar
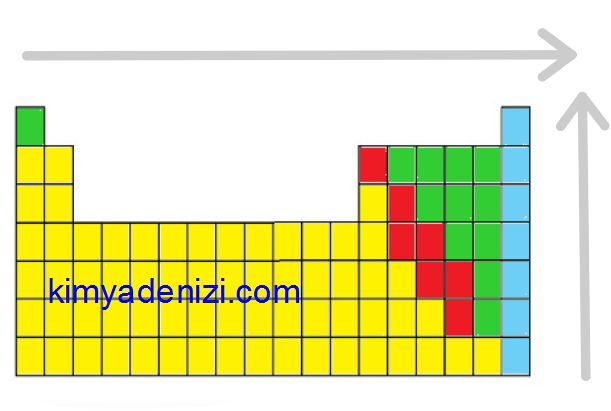
Elektronegatiflik İlgisi Artar
PERYODİK CETVELDE;
Sağdan Sola Elektronegatiflik Azalır
Yukarıdan Aşağıya Elektronegatiflik Azalır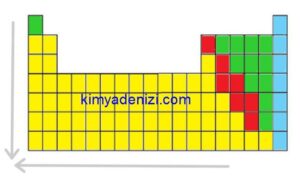
Elektronegatiflik Azalır
.
.
