Kimyasal Türler Arası Etkileşimler güçlü ve zayıf oluşuna göre iki ana grupta incelenir :
1.GÜÇLÜ ETKİLEŞİMLER (Moleküllerarası Etkileşimler Zayıf etkileşimler veya Fiziksel Bağlar)
Molekülleri birarada tutan moleküller arasındaki çekim kuvvetlerine Güçlü Etkileşimler, Moleküllerarası Etkileşimler ,Zayıf etkileşimler veya Fiziksel Bağlar denir.
2.ZAYIF ETKİLEŞİMLER (Molekül İçi Etkileşimler ,Güçlü Etkileşimler veya Kimyasal Bağlar
Molekül içindeki atomları birarada tutan çekim kuvvetlerine ise Zayıf etkileşimler Molekül İçi Etkileşimler ,Güçlü Etkileşimler veya Kimyasal Bağlar denir.
Örneğin; HF bileşiğinde;
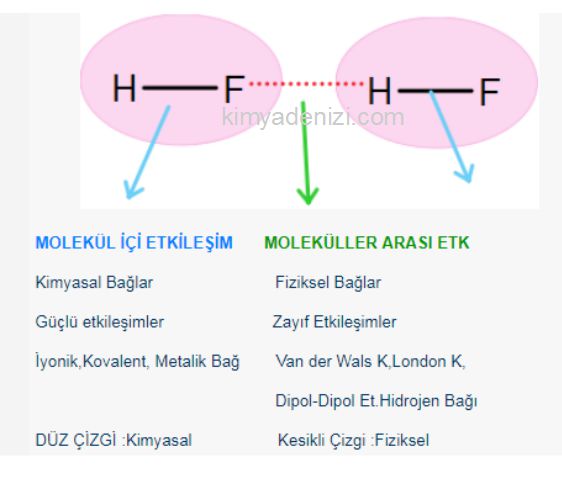
HF molekülü içindeki H ile F atomlarını birarada tutan etkileşim Kovalent Bağ dır yani Güçlü Etkileşim dir
Ama HF moleküllerinin birarada durmasının sağlayan London kuvvetleri yani Zayıf etkileşimdir
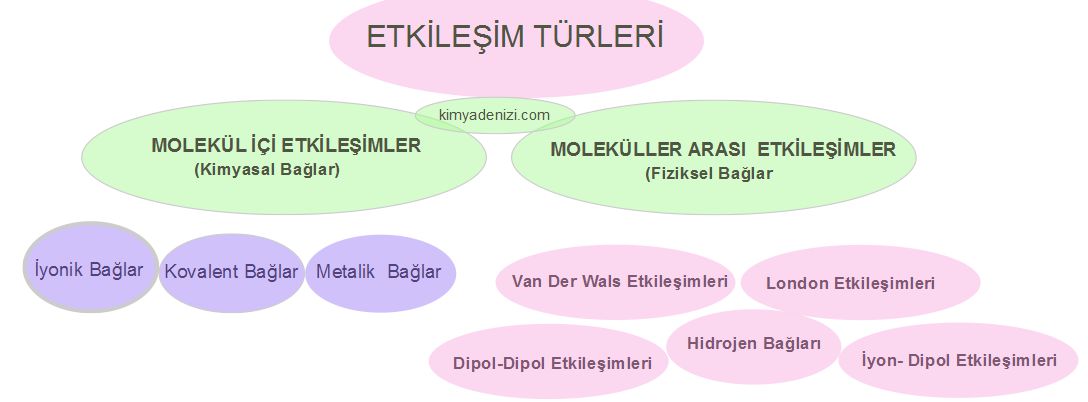
ETKİLEŞİM TÜRLERİ
Kimyasal Türler Arası Etkileşimler güçlü ve zayıf oluşuna göre iki ana grupta incelenir:
A.GÜÇLÜ ETKİLEŞİMLER ,MOLEKÜL İÇİ ETKİLEŞİMLER, Kimyasal Bağlar),
B.ZAYIF ETKİLEŞİMLER (MOLEKÜLLER ARASI ETKİLEŞİMLER ,Fiziksel Bağlar)
2.Dipol-İndüklenmiş Dipol Etkileşimleri
3.İyon-İndüklenmiş Etkileşimleri
 9.SINIF KİMYA KAZANIM TESTLERİ ÇÖZÜMLERİ İÇİN TIKLA
9.SINIF KİMYA KAZANIM TESTLERİ ÇÖZÜMLERİ İÇİN TIKLA
40 kJ mol Değeri ve Etkileşim Türünün Belirlenmesi
Kimyasal türleri birbirinden ayırmak için yaklaşık olarak 40 kJ mol-1 veya daha fazla enerji gerekiyorsa bu türler arasında bağ oluştuğu kabul edilir.Zayıf etkileşimleri yenmek için ise yaklaşık 40 kJ mol-1‘den daha az enerji gerekir.
Yaklaşık olarak ;
40 kJ mol-1 veya daha fazla eneji Güçlü Etkileşim
40 kJ mol-1 den daha az eneji Zayıf Etkileşim
kabul edilir.
Zayıf Etkileşimler Örnekler
CH4(s) + 8,1 kJ mol-1 →CH4 (g)
H20(s) + 43,9 kJ/mol → H20(g)
C2H5OH(g) → C2H5OH(s) +6,4 kJ/mol
Ar(s) + 6,4 kJ/mol → Ar(g)
Güçlü Etkileşimler Örnekler
I2(k) + 151 kJ/mol → 2 I. (g)
NaCl(K) +787 kJ/mol → Na+(g) +Cl– (g)
Nal(k) +700 kJ/mol → Na+(g) + I– (g)
NaCl(k) +787 kJ/mol → Na+(g) +Cl– (g)
Ca+2(g) + 02-(g) → CaO(k) +3850 kJ/mol
20. (g) →02(g) +498 kJ/mol
H(g) + H(g) → H2(g) + 436 kJ mol-1
MgO(k) + 3850 kJ/mol → Mg2+(g) + O2(g)
N2(g) + 163 kJ/mol → 2N (g)
H2O(g) + 463,4 kJ/mol → 2H (g) + OH (g)